

ADMINISTRACION DE PROGRAMAS ESPECIALES
Resolución 350/2006
Apruébanse las normas para la cobertura de medicación para el tratamiento de la Hepatitis Crónica.
Bs. As., 11/1/2006
VISTO la Resolución Nº 500/04 — APE; y
CONSIDERANDO:
Que los puntos 7 y 9 del Anexo VI de la Resolución citada en el VISTO establecen las condiciones que deberán respetar los Agentes del Seguro de Salud en las solicitudes de medicación para el tratamiento de las Hepatitis Crónicas B y C.
Que las Hepatitis Crónicas B y C son un problema sanitario prioritario a nivel mundial, especialmente cuando atacan a pacientes que viven con el VIH-SIDA.
Que en la actualidad se han desarrollado nuevas estrategias terapéuticas efectivas, siendo menester hacerse eco de aquellas transformaciones, incorporando normas médico asistenciales con el objetivo de priorizar los tratamientos más efectivos.
Que la Gerencia de Prestaciones en conjunto con la Sociedad Argentina de SIDA, la Sociedad Argentina de Infectología, la Sociedad Argentina de Transplante y la Asociación Argentina para el Estudio de las Enfermedades Hepáticas han desarrollado un nuevas políticas procedimentales que permitirán un mejor seguimiento de los pacientes que redundará en el perfeccionamiento de resultados en el tratamiento.
Que las normas propuestas significan un gran avance científico y técnico sin modificar de ningún modo la cobertura existente.
Que en atención a lo expuesto, resulta conveniente dictar el acto administrativo que convalide las nuevas condiciones y requisitos que deberán cumplimentar los Agentes del Seguro de Salud en sus solicitudes de cobertura financiera de la medicación para el tratamiento de la Hepatitis Crónica.
Por ello y de acuerdo con lo dispuesto a través de los Decretos Nº 53/98 y Nº 167/02
EL INTERVENTOR DE LA ADMINISTRACION DE PROGRAMAS ESPECIALES
RESUELVE:
Artículo 1º — Apruébanse las normas para la cobertura de medicación para el tratamiento de la Hepatitis Crónica que como Anexos I, II y III forma parte de la presente Resolución.
Art. 2º — Los Agentes del Seguro de Salud que soliciten la cobertura de medicación para el tratamiento de la patología mencionada en el artículo 1º deberán cumplimentar, además de los requisitos comunes exigidos por la Resolución Nº 500/04 - APE, los términos y condiciones establecidos en los Anexos de la presente Resolución.
Art. 3º — Modifícase el apartado correspondiente a Hepatitis Crónica del punto 7 del Anexo VI de la Resolución Nº 500/04 - APE el que quedará redactado de la siguiente manera: " - Hepatitis Crónica por virus B o C: Se reconocerá Interferón alfa 2a - 2b - 2a pegilado conforme los términos y condiciones establecidos en los Anexos I, II y III de la Resolución Nº 350/06 - APE".
Art. 4º — Modifícase el punto 9 del Anexo VI de la Resolución Nº 500/04 - APE el que quedará redactado de la siguiente manera: "9. Ribavirina para tratamiento de Hepatitis C, en los términos y condiciones establecidos en la Resolución Nº 350/06 - APE".
Art. 5º — Regístrese, comuníquese, publíquese, dése a la Dirección Nacional del Registro Oficial y oportunamente archívese. — Eugenio D. Zanarini.
(Nota Infoleg: por art. 1° de la Resolución N° 1200/2012 de la Superintendencia de Servicios de Salud B.O. 3/10/2012 se limita la vigencia temporal de la presente Resolución, para la tramitación de los reintegros de las prestaciones realizadas por los Agentes del Seguro, en forma previa a la publicación de la norma de referencia)
(Nota Infoleg: por art. 2° de la Resolución N° 1310/2012 de la Superintendencia de Servicios de Salud B.O. 22/10/2012 se amplía la vigencia temporal de la presente Resolución, para la tramitación de los reintegros de las prestaciones realizadas por los Agentes del Seguro hasta el 30 de noviembre de 2012)
ANEXO I
Módulo 1: HEPATITIS B
A) Portador de Infección Crónica Inactiva
Estudios de laboratorio
1) Diagnóstico: HBs Ag, HBe Ag, anti HBe y HBV DNA viral cuantitativo por PCR por método estandarizado,
2) Seguimiento: HBe Ag, anti HBe, HBV DNA viral cuantitativo por PCR por método estandarizado y Alfa feto proteína, cada 6 a 12 meses según condición clínica.
Estudios por imágenes
1) Ecografía abdominal, cada 6 a 12 meses, según condición clínica. Si fuese necesario se complementa con Tomografía helicoidal o Resonancia magnética con contraste
Biopsia hepática
1) Indicada si en el seguimiento se observa aumento de las aminotransferasas y/o aumento del HBV DNA mayor a 10000 copias/ml
Tratamiento
1) No requiere tratamiento
B) Hepatitis crónica HBe Ag positivo
Estudios de laboratorio
1) Diagnóstico: HBs Ag, HBe Ag, anti HBe y HBV DNA viral cuantitativo por PCR por método estandarizado,
2) Seguimiento: HBe Ag, anti HBe, HBV DNA viral cuantitativo por PCR por método estandarizado y Alfa feto proteína, cada 6 a 12 meses según condición clínica.
Estudios por imágenes
1) Ecografía abdominal, cada 6 a 12 meses, según condición clínica. Si fuese necesario se complementa con Tomografía helicoidal o Resonancia magnética con contraste
Biopsia hepática
1) Debe ser realizada para estadificar la enfermedad hepática a menos que exista una contraindicación para realizarla.
Tratamiento
1) en pacientes con hepatitis crónica HIV negativo
a) Interferón pegilado alfa 2a, Lamivudina y Adefovir dipivoxil.
b) Tiempo de tratamiento
i) Interferón pegilado alfa 2a: entre 6 y 12 meses
ii) Lamivudina o Adefovir dipivoxil: hasta la positivización del anti HBe, que debe persistir durante 6 meses. En caso de aparición de resistencia, se debe suspender el tratamiento con estos antivirales y rotar al otro antiviral.
2) en pacientes con cirrosis descompensada HIV negativo
a) Adefovir dipivoxil o Lamivudina.
b) Contraindicado el uso de Interferón pegilado alfa 2a.
c) Se debe contactar a un centro de trasplante hepático.
d) Tiempo de tratamiento
i) Hasta la positivización del anti HBe, que debe persistir durante 6 meses.
ii) En caso de aparición de resistencia, se debe suspender el tratamiento con estos antivirales y rotar al otro antiviral.
C) Hepatitis crónica con HBe Ag negativo y actividad persistente de aminotransferasas
Estudios de laboratorio
1) Diagnóstico: HBs Ag, HBe Ag, anti HBe y HBV DNA viral cuantitativo por PCR por método estandarizado,
2) Seguimiento: HBe Ag, anti HBe, HBV DNA viral cuantitativo por PCR por método estandarizado y Alfa feto proteína, cada 6 a 12 meses según condición clínica.
Estudios por imágenes
1) Ecografía abdominal, cada 6 a 12 meses, según condición clínica. Si fuese necesario se complementa con tomografía helicoidal o resonancia magnética nuclear con contraste.
Biopsia hepática
2) Debe ser realizada para estadificar la enfermedad hepática a menos que exista una contraindicación para realizarla.
Tratamiento
1) Interferón pegilado alfa 2a, Lamivudina y Adefovir dipivoxil.
2) Tiempo de tratamiento
a) Interferón pegilado alfa 2a: 12 meses.
b) Lamivudina o Adefovir dipivoxil: mínimo, 2 años.
3) en pacientes con cirrosis descompensada HIV negativo
a) Adefovir dipivoxil o Lamivudina.
b) Contraindicado el uso Interferón pegilado alfa 2a.
c) Se debe contactar a un centro de trasplante hepático.
4) Tiempo de tratamiento
a) Adefovir dipivoxil o Lamivudina, 2 años.
D) Hepatitis crónica B + HIV positivo
1) Con indicación de HAART
a) Pacientes sin tratamiento previo: asociar Lamivudina y Tenofovir como parte del esquema antirretroviral.
b) Pacientes con tratamiento previo con Lamivudina, con o sin resistencia, agregar Tenofovir.
2) Sin indicación de HAART
a) No emplear drogas con actividad anti HBV y anti HIV.
b) De acuerdo a la condición clínica usar Interferón pegilado alfa 2a o Adefovir dipivoxil.
3) Pacientes con cirrosis HIV positivo
a) Con indicación de HAART
i) Pacientes sin tratamiento previo: asociar Lamivudina y Tenofovir como parte del esquema antirretroviral.
ii) Pacientes con tratamiento previo con Lamivudina, con o sin resistencia agregar Tenofovir.
b) Sin indicación de HAART
i) No emplear drogas con actividad anti HBV y anti HIV. Utilizar Adefovir dipivoxil.
ii) Contraindicado el uso de Interferón pegilado alfa 2a o 2b.
4) Recomendaciones:
a) No emplear drogas con actividad anti HBV y anti HIV. Utilizar Adefovir dipivoxil.
b) Contraindicado el uso de Interferón pegilado alfa 2a o 2b.
c) Considerar la indicación de trasplante hepático cuando presente: Carga viral HIV No detectable, CD4 > 100 cel/µl, abstinencia de drogas y alcohol en los últimos 6 meses.
d) Para evaluar respuesta se debe considerar el comportamiento de HBV DNA, HBe Ag, anti Hbe y aminotransferasas.
E) Respuesta Intratratamiento
1) Criterios bioquímicos
a) Respuesta: normalización de las aminotransferasas.
b) No respuesta: persistencia de la hipertransaminasemia.
2) Criterios virológicos
c) Respuesta: Descenso de la carga viral >1 logaritmo al 3º mes.
d) No respuesta: Descenso <1 logaritmo del HBV DNA al 3º mes.
e) Resistencia: Elevación > 1 log en relación al descenso inicial.
3) Criterios serológicos
f) Seroconversión completa: HBe Ag negativo con anti HBe positivo.
g) Seroconversión incompleta: HBe Ag negativo con anti HBe negativo.
h) Respuesta completa: HBs Ag negativo y anti HBs positivo.
i) Respuesta incompleta: HBs Ag negativo y anti HBs negativo.
j) No respuesta: HBe Ag positivo.
F) Respuesta postratamiento inmediato
1) Criterios bioquímicos
a) Respuesta: normalización de las aminotransferasas.
b) No respuesta: persistencia de la hipertransaminasemia.
2) Criterios virológicos
c) Respuesta: Carga viral < 100.000 copias/ml.
d) No respuesta: Carga viral >100.000 copias/ml.
3) Criterios serológicos
e) Seroconversión completa: HBe Ag negativo con anti HBe positivo.
f) Seroconversión incompleta: HBe Ag negativo con anti HBe negativo.
g) Respuesta completa: HBs Ag negativo y anti HBs positivo.
h) Respuesta incompleta: HBs Ag negativo y anti HBs negativo.
i) No respuesta: HBe Ag positivo.
G) Respuesta postratamiento tardío (a los 6 meses)
1) Criterios bioquímicos
a) Respuesta sostenida: aminotransferasas normales.
b) Recaída: hipertransaminasemia luego de haber estado normales al finalizar el tratamiento.
|
FINANCIACION APE DEL MODULO 1 |
1) Drogas:
a) Interferón pegilado alfa 2a1: Según valor de referencia APE
b) Lamivudina 100 mg: Según valor de referencia APE
c) Adefovir dipivoxil 100 mg: Según valor de referencia APE
2) Diagnóstico y Seguimiento:
a) Determinación de Carga viral para HBV: $ 250 (hasta dos por año).
Módulo 2: HEPATITIS C
A) Hepatitis aguda C
Estudios de laboratorio.
1) Diagnóstico: Anti HCV y HCV RNA por técnica de PCR cualitativa.
––––––––––––––
1 El Interferón alfa 2b no tiene indicación aprobada por ANMAT para tratamiento de la hepatitis B.
2) Para decidir conducta terapéutica: genotipo y HCV RNA cualitativo.
3) Seguimiento: HCV RNA cualitativo al 4º mes.
4) Curación: HCV RNA no detectable en dos oportunidades con intervalo de tres meses.
Estudios por imágenes
1) Ecografía abdominal realizada al momento del diagnóstico presuntivo de hepatitis.
2) Ecografía abdominal durante el seguimiento, cuando cambie la condición clínica o cuando se sospecha evolución a la cronicidad.
Biopsia hepática
1) Debe realizarse sólo en caso de sospecha clínica de hepatitis crónica.
Tratamiento
1) Iniciar tratamiento si hay HCV RNA detectable al 4º mes del diagnóstico, con
2) PEG IFN alfa 2a o 2b durante 6 meses. Debe comenzarse inmediatamente después de conocerse el resultado de HCV RNA.
B) Hepatitis crónica C
Estudios de laboratorio
1) Diagnóstico: Anti HCV y HCV RNA.
2) Seguimiento: Alfa feto Proteína y ecografía abdominal: en caso de cirrosis o fibrosis avanzada, cada 6 meses.
Estudios por imágenes
1) Diagnóstico: Ecografía abdominal.
2) Seguimiento: Si fuese necesario se complementa con Tomografía helicoidal o Resonancia magnética con contraste
Biopsia hepática
1) Debe ser realizada para estadificar la enfermedad hepática a menos que exista una contraindicación para realizarla.
Tratamiento
1) Se debe efectuar evaluación virológica pretramiento con Genotipo HCV y Carga viral HCV por técnica estandarizada
2) Genotipos 1 y 4:
a) PEG IFN alfa 2a 180 µg subcutáneo por semana asociado a Ribavirina 1 a 1,2 g por vía oral por día durante 12 meses.
b) PEG IFN alfa 2b 1,5 µg subcutáneo, por Kg de peso corporal, por semana asociado a Ribavirina 1 a 1,2 g por vía oral por día durante 12 meses.
3) Pacientes con contraindicación al uso de Ribavirina
a) PEG IFN alfa 2a 180 µg subcutáneo por semana durante 12 meses, o
b) PEG IFN alfa 2b 1 µg subcutáneo por Kg de peso corporal por semana durante 12 meses.
4) Genotipo 2 y 3
a) PEG IFN alfa 2a 180 µg subcutáneo por semana, asociado a Ribavirina 800 mg por vía oral por día durante 6 meses.
b) PEG IFN alfa 2b 1.5 µg subcutáneo por Kg de peso corporal por semana, asociado a Ribavirina 800 mg por vía oral por día durante 6 meses.
c) En pacientes con contraindicación al uso de Ribavirina:
i) PEG IFN alfa 2a 180 µg subcutáneo por semana durante 12 meses o
ii) PEG IFN alfa 2b 1 µg por Kg de peso corporal subcutáneo por semana durante 12 meses.
Evaluación de la respuesta lntratratamiento
1) Carga viral al 3º mes.
a) Respuesta virológica rápida: HCV RNA no detectable
b) Respuesta virológica lenta: HCV RNA detectable con descenso =2 log. (En estos casos realizar HCV RNA cualitativo al 6 mes)
c) No respuesta: caída <2 log al 3º mes o detección de HCV RNA al 6º mes: suspender el tratamiento.
Evaluación de la respuesta al finalizar el tratamiento y/o a los 6 meses
1) Respondedor: HCV RNA no detectable
2) No respondedor: HCV RNA detectable
––––––––––––––
NOTA: En pacientes con monoterapia con PEG IFN, el primer control de HCV RNA debe realizarse al 6to. mes de tratamiento.
Tratamiento de la hepatitis crónica C con cirrosis compensada.
1) El período de tratamiento es de 48 semanas, independientemente del genotipo del HCV. Sin embargo, falta definir si la prolongación del tiempo de la terapia en los portadores de genotipos 1 y 4 aumenta el porcentaje de respuestas virales sostenidas. La terapia con PEG IFN + RBV no tiene un impacto negativo en la evolución de la enfermedad por HIV.
Tratamiento de la hepatitis aguda C.
1) Los enfermos con hepatitis aguda C que no erradican espontáneamente el HCV RNA sérico a las 12 semanas de iniciada las manifestaciones clínicas o los hallazgos de laboratorio, deben recibir tratamiento.
2) Se recomienda tratar con PEG IFN sólo o con la asociación PEG IFN + RBV, durante un período de 24 a 48 semanas. La evaluación de la respuesta debe realizarse con HCV RNA (método cualitativo) al final del tratamiento y a los seis meses de finalizado.
Evaluación de la respuesta al finalizar el tratamiento y/o a los 6 meses
1) Respondedor: HCV RNA no detectable
2) No respondedor: HCV RNA detectable
Tratamiento en pacientes con cirrosis descompensada HIV negativo
1) Drogas contraindicadas.
2) Se debe contactar a un centro de trasplante hepático.
Coinfección HIV-HCV
1) Todos los pacientes coinfectados, agudos o crónicos, son candidatos potenciales a recibir tratamiento con la asociación Interferón Pegilado +Ribavirina, esquema considerado el estándar terapéutico actual.
Genotipo de HCV.
1) Sólo se determina en pacientes con HCV RNA Positivo y que van a recibir terapia antiviral. Es imprescindible realizar esta determinación antes de iniciar la terapia.
Tratamiento en pacientes con hepatitis crónica con o sin cirrosis, HIV positivo
1) Pacientes sin indicación de HAART.
a) PEG IFN alfa 2a 180 µg subcutáneo por semana, asociado a Ribavirina 1 a 1,2 g por vía oral por día durante 12 meses en todos los genotipos HCV.
b) PEG IFN alfa 2b 1,5 µg subcutáneo por Kg de peso corporal por semana asociado, a Ribavirina 1 a 1,2 g por vía oral por día durante 12 meses, en todos los genotipos HCV.
2) Pacientes con contraindicación al uso de Ribavirina
a) PEG IFN alfa 2a 180 µg subcutáneo por semana durante 12 meses, en todos los genotipos HCV o
b) PEG IFN alfa 2b 1 µg por Kg de peso corporal subcutáneo por semana durante 12 meses, en todos los genotipos HCV.
D) Evaluación de la respuesta intratratamiento
1) Carga viral al 3º mes.
a) Respuesta virológica rápida: HCV RNA no detectable
b) Respuesta virológica lenta: HCV RNA detectable con descenso =2 log. En estos casos realizar HCV RNA cualitativo al 6º mes.
c) No respuesta: caída <2 log al 3º mes o detección de HCV RNA al 6º mes: suspender el tratamiento.
E) Evaluación de la respuesta al finalizar el tratamiento y/o a los 6 meses
1) Respondedor: HCV RNA no detectable
2) No respondedor: HCV RNA detectable
Notas:
1) Todo paciente coinfectado HIV-HCV es candidato potencial a recibir tratamiento de la hepatitis C.
2) En pacientes con monoterapia con PEG IFN el primer control de HCV RNA debe realizarse al 6to. mes de tratamiento.
3) En pacientes con indicación de HAART:
a) Priorizar el tratamiento antirretroviral.
b) Una vez controlada la infección HIV, iniciar tratamiento de la hepatitis C con el mismo esquema del apartado anterior
Tratamiento en pacientes con cirrosis descompensada HIV positivo
1) Todas las drogas están contraindicadas.
2) Se debe contactar a un centro de trasplante hepático.
Hepatotoxicidad en pacientes coinfectados.
1) La hepatitis C es un factor de riesgo independiente para el desarrollo de hepatotoxicidad por antirretrovirales. Para definir hepatotoxicidad se recomienda respetar los criterios ya establecidos que la gradúan de 1 a 4.
2) Debe tenerse en cuenta que los pacientes coinfectados pueden tener múltiples causas de enfermedad hepática o alteraciones bioquímicas aisladas antes y durante el tratamiento, por lo que para adoptar conductas terapéuticas se sugiere considerar la presencia de manifestaciones clínicas, relación entre dosis y tiempo de exposición y alternativas terapéuticas.
3) La biopsia hepática puede ser útil para definir diagnósticos diferenciales de toxicidad hepática. El hallazgo histológico compatible con microesteatosis o daño por hipersensibilidad puede avalar el diagnóstico de toxicidad hepática.
4) Se recomienda la suspensión del tratamiento ante la presencia de manifestaciones clínicas de injuria hepática aguda o hiperlactacidemia sintomática o ambas.
5) Los inhibidores no nucleósidos de la transcriptasa reversa (INNTR), en particular la Nevirapina, tienen mayor potencial hepatotóxico en coinfectados.
Evaluaciones previas al tratamiento.
1) Todo paciente seleccionado para tratamiento debe ser evaluado previamente con:
a) Hemograma completo con recuento de plaquetas, función tiroidea, lipidograma y autoanticuerpos.
b) Carga viral y genotipo del HCV.
c) Conductas adictivas.
d) Estado nutricional.
e) Estado de salud mental (cuando fuese necesario).
f) Examen oftalmológico.
g) Evaluación cardiopulmonar.
h) Biopsia hepática: se recomienda su realización, debido a que puede brindar información adicional de utilidad en la conducta terapéutica.
Decisiones Terapéuticas.
1) Los coinfectados con recuento de CD4+ =200 células/mm3 (o con valores persistentes y estables de CD4+ -entre 100 y 200 células/mm3- con CV no detectable e infección HIV clínicamente estable) deben ser tratados con PEG IFN + RBV, a menos que exista una contraindicación para el uso de RBV.
2) En aquellos con recuento de CD4+ <200 células/mm3, debe priorizarse el tratamiento HAART hasta mejorar y estabilizar los niveles de CD4+.
Tratamiento de coinfectados HIV-HBV-HCV.
1) No hay información disponible, por lo que es imprescindible realizar estudios prospectivos.
2) Se recomienda tratar la hepatitis que muestre virus con actividad replicativa dominante, manteniendo una estrecha vigilancia sobre el otro virus involucrado.
Interacciones farmacológicas en coinfectados.
1) Debido al mayor riesgo de hiperlactacidemia sintomática en pacientes que reciben D4T, DDI o AZT asociados a PEG IFN + RBV, se aconseja evitar su uso concomitante.
2) La combinación AZT con PEG IFN + RBV puede incrementar la presencia de anemia.
3) En pacientes con antecedentes de depresión debe tenerse precaución con el uso concomitante de EFV y PEG IFN.
Manejo de los efectos adversos del tratamiento de la hepatitis C.
1) El perfil de seguridad de la combinación PEG IFN + RBV en el coinfectado es similar al observado en el monoinfectado y las pautas recomendadas para su manejo son similares en ambas poblaciones.
2) No se ha observado que PEG IFN comprometa la respuesta inmunológica del paciente coinfectado.
3) Paracetamol, eritropoyetina recombinante humana, factores estimulantes de colonias, e inhibidores de la recaptación de serotonina, son herramientas útiles para el manejo de los efectos secundarios del tratamiento en el coinfectado, para asegurar el mantenimiento de dosis terapéuticas óptimas.
4) La adherencia al tratamiento es un pilar fundamental de la efectividad terapéutica en el paciente coinfectado. Para lograrla, el diagnóstico precoz y el manejo adecuado de los efectos adversos del HAART y del tratamiento para la hepatitis C son esenciales. Estos objetivos se alcanzan a través del trabajo asistencial interdisciplinario y de la educación de los pacientes, que incluye conocer la importancia de la adherencia, los efectos adversos y de su manejo, las pautas de alarma y la necesidad de controles periódicos.
5) Tratamiento del Hepatocarcinoma (HCC).
6) La historia natural del HCC en los pacientes coinfectados HCV-HIV no es bien conocida. Sin embargo, existen reportes que señalan la posibilidad de mayor incidencia de HCC en estadios más precoces de la enfermedad hepática así como también de una evolución más agresiva. Esto podría tener implicancias en la estrategia de detección temprana de esta complicación sugiriéndose que la pesquisa con ecografía y FP podría comenzar en estadios no cirróticos de la enfermedad hepática e incluso que podría realizarse en intervalos inferiores a los aplicables para la población con hepatitis C sin infección por HIV (<6 meses).
7) Se considera que los pacientes con coinfección HIV-HCV y HIV-HBV-HCV, sin o con HAART deben ser candidatos a recibir los mismos tratamientos para el HCC que la población con monoinfección HCV.
8) Sobre la base de la experiencia en la población con monoinfección HCV, el tratamiento del HCC incluye tratamientos potencialmente curativos (radiofrecuencia, inyección percutánea de alcohol, termoablación, resección quirúrgica o transplante hepático) y terapias que, aún sin potencial curativo, puedan incrementar la sobrevida de los pacientes como la quimioembolización arterial.
9) La experiencia con estos tratamientos en coinfectados es escasa, pero los resultados obtenidos hasta la actualidad sugieren que los que acceden a terapias para el HCC podrían beneficiarse con un aumento en la sobrevida.
La elección del tratamiento a indicar es individual y se debe sustentar en las características del tumor, de la enfermedad hepática y del estado del paciente en relación a su enfermedad por HIV.
Respuesta intratratamiento
1) Evaluar viremia intratratamiento (semana 12 y/o semana 24)
a) Respuesta Virológica Precoz (RVP): HCV RNA no detectable y/o descenso =2 Iog10 del valor inicial (método cuantitativo).
b) No respuesta: persistencia de HCV RNA en la semana 24 por método cualitativo.
Respuesta postratamiento inmediato
1) Evaluar viremia al finalizar la terapia.
a) Respuesta: negativización del HCV RNA (método cualitativo).
Respuesta postratamiento tardío
1) Evaluar viremia al finalizar la terapia.
a) Respuesta Virológica Sostenida (RVS): HCV RNA (método cualitativo) no detectable a los 6 meses de finalizada la terapia.
––––––––––
NOTAS:
1) La RVP tiene valor predictivo sobre la RVS. En aquellos casos en los que no se observa RVP se debería suspender el tratamiento. Sin embargo, cuando el enfermo es portador de una fibrosis avanzada o cirrosis, se puede continuar la terapia hasta completar las 48 semanas con el objetivo de enlentecer o prevenir la progresión de la hepatopatía.
2) En los pacientes que presentan RVS, el seguimiento a largo plazo debe hacerse con una determinación de HCV RNA (método cualitativo) anual o ante cualquier evento clínico que lo justifique. En los pacientes con cirrosis también deben realizarse los controles periódicos para la detección de las complicaciones de ésta.
3) Aquellos pacientes no respondedores o con recaída que no hubiesen recibido el tratamiento combinado en dosis y tiempo adecuados, son pasibles de retratamiento.
Dentro de los módulos de tratamiento y seguimiento para HEPATITIS C crónica se reconocerán las siguientes prestaciones
Drogas para Tratamiento:
· Interferón pegilado alfa 2a y alfa2b2 Según valor de referencia APE
–––––––––––––
² Interferón alfa 2b no tiene indicación aprobada por ANMAT para el tratamiento de la coinfección HIV/HCV.
· Ribavirina: Valor de referencia APE
Diagnóstico y Seguimiento:
· Determinación de Genotipo para HCV 1 (única vez) $ 300
· Determinación de Carga viral para HCV 2 (dos) al iniciar tratamiento y a la semana 12 del mismo Valor APE: $ 250.
Criterios:
1) APE no subsidiará ni reintegrará aquellos tratamientos considerados subóptimos, interrumpidos o discontinuados sin causa justificada.
2) Dentro de este módulo, que se rendirá en forma semestral, en expediente separado y por paciente, se adjuntará la Historia Clínica APE obrante en el ANEXO III, debidamente confeccionada por el profesional tratante, correspondiente al período solicitado.
3) En los casos en donde la prestación sea por menos de seis meses o cuando dentro de un semestre se solicite subsidio o reintegro por tratamiento por menor tiempo, la auditoría médica deberá presentar un informe detallando el porqué de la menor prestación.
4) Se actuará del mismo modo en los casos en que el beneficiario haya abandonado su tratamiento y seguimiento, adjuntándose en este particular un informe detallado sobre lo ejecutado por la peticionante fin de reintroducir al beneficiario al tratamiento instituido por el profesional actuante.
|
FINANCIACION APE DEL MODULO 2 |
1) Drogas:
d) Interferón pegilado, alfa 2a y alfa 2b3: Según valor de referencia APE
e) Ribavirina: Se entrega sin cargo junto con el PEG IFN.
2) Diagnóstico y Seguimiento:
b) Determinación de Carga viral para HCV: $ 250 (hasta una al inicio y otra en la semana 12 de tratamiento).
c) Determinación de Genotipo HCV: $ 300 (una por paciente).
CRITERIOS DE LA APE PARA INTERPRETACION DE LOS MODULOS 1 Y 2:
1) No se financiarán aquellos tratamientos considerados subóptimos, interrumpidos o discontinuados sin causa justificada.
2) Este módulo se rendirá en forma semestral, en expediente separado y por paciente, adjuntando copia de la Historia Clínica (según modelo APE obrante en el ANEXO III), debidamente confeccionada por el profesional tratante y correspondiente al período solicitado.
3) Cuando existan razones para que la solicitud sea por menos de seis meses, la auditoría médica de la Obra Social deberá presentar un informe detallando el porqué del menor período de prestación.
4) Se actuará del mismo modo en los casos en que el beneficiario haya abandonado su tratamiento, adjuntándose en este particular un informe detallado sobre lo ejecutado por la peticionante a fin de reintroducir al beneficiario al tratamiento instituido por el profesional actuante.
ANEXO II
Transplante Hepático en pacientes HIV+
1) El transplante hepático constituye la única alternativa terapéutica definitiva en ciertos pacientes infectados por HIV, que presentan enfermedad hepática terminal por coinfección por HCV.
2) La experiencia acumulada hasta la actualidad indica que la supervivencia a los 3 años del transplante hepático es similar a la de los pacientes con monoinfección por HCV.
Criterios de trasplantabilidad:
1) Criterios relacionados con la enfermedad hepática.
a. Cirrosis hepática con score de Child-Pugh =7 o cirrosis descompensada con alguna de las siguientes complicaciones: ascitis, ictericia, encefalopatía hepática, hemorragia digestiva secundaria a hipertensión portal,
b. HCC que cumple con los criterios de trasplantabilidad de Milán (un nódulo =5 cm o hasta 3 nódulos =3 cm, sin enfermedad extrahepática o invasión vascular)
c. Valoración psiquiátrica y social favorable.
2) Criterios relacionados con la coinfección HIV.
a. Linfocitos CD4+ >100 células/mm3,
b. HIV RNA no detectable o suprimible con HAART,
c. Ausencia de antecedentes de infecciones oportunistas a excepción de tuberculosis, candidiasis esofágica o neumonía por Pneumocystis jiroveci. En estos casos se requiere recuento de CD4+ >200 células/mm3 y 6 meses sin evidencias de complicaciones.
d. En la actualidad no existe experiencia suficiente con el resto de las infecciones oportunistas y los tumores relacionados con la infección por el HIV como para realizar recomendaciones.
3) Criterios psiquiátricos
a. Abstinencia a la heroína y cocaína de 2 años de duración, entendiéndose que estos pacientes ya estarían, en cuanto a la dependencia, en recuperación sostenida. Ocasionalmente se puede considerar la inclusión de estos pacientes en lista de espera para transplante antes de tal plazo, en función de la evaluación psiquiátrica individualizada.
b. En el caso del alcohol, se requiere un período de abstinencia de 6 meses debido a la alta tasa de recaídas en el post trasplante.
–––––––––––
³ EI Interferón alfa 2b no tiene indicación aprobada por ANMAT para tratamiento de la HBV ni coinfección HIV/HCW.
4) Criterios de selección del donante: iguales para enfermedad hepática y para coinfectados con HIV
a. Donante cadavérico
b. Donante vivo relacionado
c. Debido a la progresión acelerada de la enfermedad hepática en los coinfectados HIV-HCV, es recomendable su derivación temprana a un centro de transplante para su evaluación.
No existen evidencias que en los pacientes coinfectados se presente una mayor frecuencia de complicaciones en el post trasplante inmediato, ni en lo que respecta a la incidencia de rechazo celular agudo ni de complicaciones infecciosas. Los principales problemas del período postrasplante son las interacciones farmacocinéticas y farmacodinámicas entre los ARV y los inmunosupresores, lo que dificulta el manejo de dosis adecuadas estas últimas, por lo que se requiere un monitoreo más frecuente. Con respecto al tratamiento del rechazo, el mismo debe ajustarse a los lineamientos empleados en el manejo en pacientes monoinfectados por HCV. Las estrategias dirigidas a controlar la recurrencia de la hepatitis C deben ser prioritarias, debido a que la recidiva de ésta es el principal condicionante de una evolución desfavorable en el postrasplante alejado. La experiencia en estos pacientes con PEG IFN + RBV es escasa hasta el momento actual.
No existen evidencias en relación a la posibilidad de una mayor susceptibilidad a infecciones oportunistas o tumores en pacientes con infección HIV que reciben un trasplante hepático.
Criterios de exclusión:
1) Cáncer, salvo hepatocarcinoma
2) Sepsis antes de las 48 de tratamiento con antibióticos o con hemocultivo positivo
3) Infección con Aspergilius
4) Falla multiorgánica
5) Contraindicaciones cardiovasculares
6) Hipertensión pulmonar
Causas de retrasplante inmediato:
1) Trombosis de arteria hepática
2) Trombosis de vena porta (más común en niños)
3) Rechazo hiperagudo
4) Recidiva inmediata del virus c
Las presentaciones por transplante se deberán guiar por las normas de la Resolución 500/04- APE.
ANEXO III

––––––––––
¹ De ser paciente con HIV/SIDA
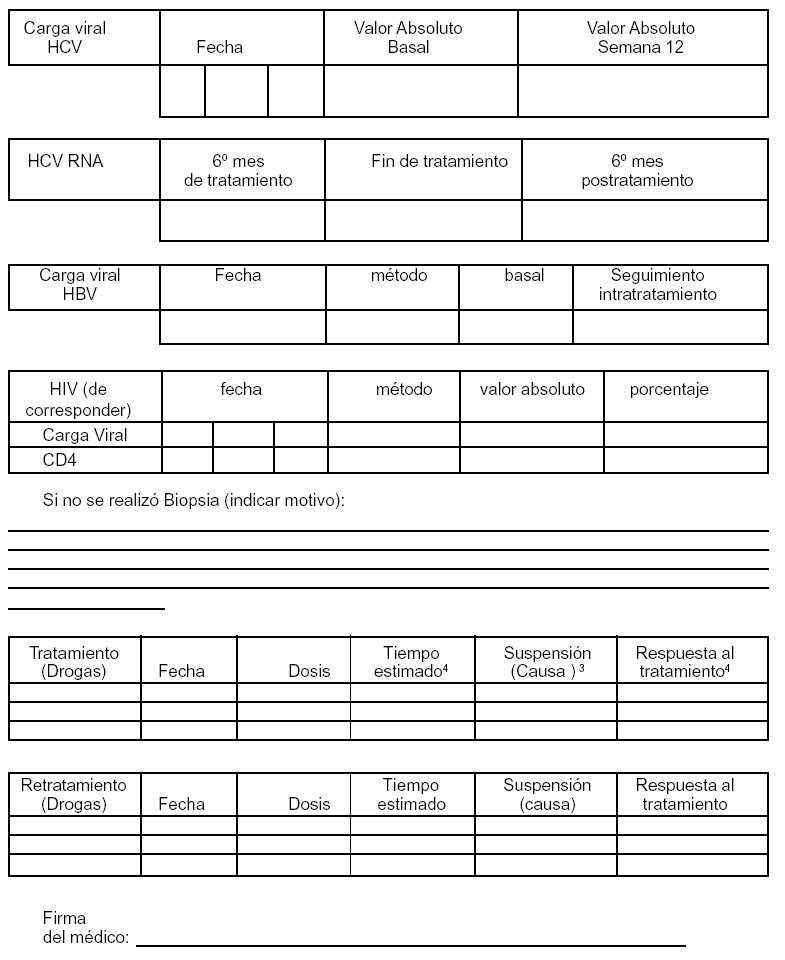
––––––––––––
2 Tiempo estimado de tratamiento.
3 Indicar el motivo de la suspensión: Efectos adversos- falta de respuesta al tratamiento- falta de adherencia- Fin de tratamiento.
4 Colocar qué tipo de respuesta está teniendo al tratamiento: RVS - RR - NR.