

INSTITUTO NACIONAL CENTRAL UNICO COORDINADOR DE ABLACION E IMPLANTE
Resolución 309/2007
Apruébase la clasificación de las indicaciones médicas para la realización de trasplantes autólogos, alogénicos y no relacionados, de células progenitoras hematopoyéticas provenientes de la médula ósea, sangre periférica o sangre de cordón umbilical y la placenta. Créase la Comisión Asesora de Transplante de Células Progenitoras Hematopoyéticas.
Bs. As., 27/9/2007
VISTO el expediente Nº 1 2002 4638000064/07-7 del Registro de este INSTITUTO NACIONAL CENTRAL UNICO COORDINADOR DE ABLACION E IMPLANTE, las Leyes Nº 24.193 (t.o. Ley Nº 26.066) y 25.392 y sus reglamentaciones aprobadas por Decretos Nº 512/95 y 267/03, los Decretos Nº 1125/00 y Nº 1949/06 del P.E.N.; y
CONSIDERANDO
Que la normativa citada precedentemente determina la competencia de este Instituto Nacional en aquellas prácticas vinculadas a la obtención y preservación de células progenitoras hematopoyéticas (CPH), provenientes de sus diferentes modalidades de recolección (médula ósea, sangre periférica o sangre del cordón umbilical y la placenta) y su posterior implante a seres humanos, además de la creación de un registro nacional de donantes de dichas células en el ámbito de este Instituto Nacional.
Que el Decreto Nº 1949/06 establece que la obtención, preservación y el implante de CPH comprende las maneras de recolección referidas y aquellas que en el futuro la tecnología permita incorporar para la realización de trasplantes autólogos y alogénicos.
Que asimismo el Decreto Nº 1125/00 incorpora al artículo 2º de la Ley Nº 24.193 la ablación e implantación de cordón umbilical como práctica de técnica corriente, debiendo interpretarse que dicha norma hace referencia a las CPH existentes en la sangre ubicada en el cordón umbilical (SCU) y la placenta luego del alumbramiento.
Que la utilización de CPH ha experimentado un notorio crecimiento en los últimos años, ya que la misma se ha convertido en una modalidad terapéutica para una gran variedad de enfermedades, a tal punto que en la actualidad se trasplantan más de 30.000 pacientes al año en todo el mundo.
Que en este sentido los avances farmacológicos y tecnológicos han permitido disminuir significativamente la morbimortalidad del procedimiento en todas sus formas, logrando alcanzar un porcentaje creciente de remisiones completas, mejorar la sobrevida libre de enfermedad y la sobrevida total, en pacientes con afecciones hematológicas, hemato-oncológicas y oncológicas.
Que la importancia asistencial de estas prácticas se ha incrementado ostensiblemente al incorporarse nuevas indicaciones para su empleo, ya que junto a las clásicas aplicaciones en enfermedades malignas hematológicas (leucemias, linfomas, mieloma), aplasia medular, inmunodeficiencias congénitas y otros defectos congénitos, se ha ampliado su uso a las neoplasias sólidas.
Que se requiere la adecuada evaluación de dichas tecnologías para medir el impacto que tienen en la atención de la salud.
Que como consecuencia de lo expuesto, resulta necesario clasificar las indicaciones médicas para el empleo de las referidas células en distintos tipos de enfermedades, determinando el procedimiento administrativo aplicable para la correspondiente disponibilidad de las mismas.
Que el Subcomité del Grupo Europeo de Trasplante de Médula Osea ha efectuado en el mes de febrero de 2006 recomendaciones para la práctica de trasplante de CPH autólogo, alogénico y no relacionado, las cuales resultan pertinente considerar a los fines señalados, por el prestigio y consenso que dicho cuerpo mantiene en ámbitos científicos y médicos internacionales.
Que la Sociedad Argentina de Hematología manifestó su conformidad con las recomendaciones establecidas por el subcomité del grupo Europeo de Trasplante de Médula Osea.
Que se ha consultado al Grupo Argentino de Médula Osea (GATMO).
Que la Comisión Federal de Trasplante (CO.FE.TRA.) ha tomado la intervención correspondiente, canalizando de esta manera el asesoramiento del Consejo Federal de Salud (CO.FE.SA.) previsto en el inciso b) del artículo 44 de la Ley 24.193 y Decreto 512/95.
Que en la elaboración de la presente norma se ha dado participación al Comité de Bioética de este Instituto Nacional en el marco de sus atribuciones.
Que el Registro Nacional de Donantes de Células Progenitoras Hematopoyéticas, la Dirección Científico Técnica y el Departamento de Asuntos Jurídicos han tomado la intervención de su competencia.
Que la presente medida se dicta en uso de las competencias otorgadas por el artículo 44 de la Ley 24.196 y el artículo 2 de la Ley 25.392 y Decreto 267/03.
Por ello;
EL DIRECTORIO DEL INSTITUTO NACIONAL CENTRAL UNICO COORDINADOR DE ABLACION E IMPLANTE
RESUELVE:
Artículo 1º — Apruébase la clasificación de las indicaciones médicas para la realización de trasplantes autólogos, alogénicos y no relacionados, de células progenitoras hematopoyéticas (CPH) provenientes de la médula ósea, sangre periférica o sangre del cordón umbilical y la placenta, conforme el listado obrante en el ANEXO I de la presente resolución.
Art. 2º — Dispónese el procedimiento administrativo aplicable para el otorgamiento de la correspondiente autorización del empleo de CPH en distintos tipos de enfermedades, de acuerdo a los mecanismos establecidos en el ANEXO II que forma parte integrante de la presente.
Art. 3º — Créase la Comisión Asesora de Trasplante de Células Progenitoras Hematopoyéticas, a cuyo efecto se invitará para su integración a todos los jefes de equipo habilitados en el país para dicha práctica y a dos representantes, uno de la Sociedad Argentina de Hematología y el otro del Grupo Argentino de Médula Osea (GATMO), la que a través de sus recomendaciones de carácter no vinculante, asesorará al Directorio de este Instituto, a los fines de la ejecución de la presente norma.
Art. 4º — Sin perjuicio de la actualización permanente que requiere la resolución que se dicta, las áreas competentes del INCUCAI conjuntamente con la Comisión creada en el artículo precedente y la Comisión Federal de Trasplante (CO.FE.TRA.), al término de dos (2) años de su entrada en vigencia procederán al análisis y evaluación de la misma a efectos que el Directorio resuelva la continuidad de su aplicación.
Art. 5º — Regístrese. Notifíquese a la Secretaría de Políticas, Regulación y Relaciones Sanitarias del Ministerio de Salud de la Nación, a las Autoridades Sanitarias Provinciales, a la Superintendencia de Servicios de Salud, a la Administración de Programas Especiales, a los Organismos Jurisdiccionales de Ablación e Implante, a la Sociedad Argentina de Trasplantes, a la Asociación Argentina de Hemoterapia e Inmunohematología, al Grupo Argentino de Trasplante de Médula Osea, la Sociedad Argentina de Hematología, al Consejo Asesor de Pacientes y al Consejo Asesor de Profesionales. Comuníquese a las áreas competentes del Instituto, publíquese, dése a la Dirección Nacional del Registro Oficial y archívese. — Armando M. Perichón. — Martín Torres.
ANEXO I
CLASIFICACION DE INDICACIONES MEDICAS PARA TRASPLANTE DE CPH
Clínicamente Aprobada (A)
Este tipo de indicaciones se encuentran definidas y con mejores resultados que otros tratamientos que no incluyen el trasplante.
Opción Clínica (OC)
En esta categoría el trasplante de CPH es una opción válida para pacientes, luego de un cuidadoso análisis de los riesgos y beneficios del tratamiento propuesto. Será necesario evaluar la disponibilidad del donante, la fuente de CPH y la inmunosupresión a utilizar, como variables que incidirán en el resultado del trasplante.
Experimental (EXP)
En este tipo de indicaciones hay poca experiencia; los estudios clínicos adicionales son necesarios a fin de definir el rol del trasplante de CPH en estas patologías. Se incluirá en este grupo toda otra indicación no contemplada en la presente norma.
Generalmente No Recomendada (GNR)
Esta categoría incluye estadios tempranos de enfermedades, en las cuales los resultados del tratamiento convencional no justifican el riesgo de mortalidad asociado al trasplante
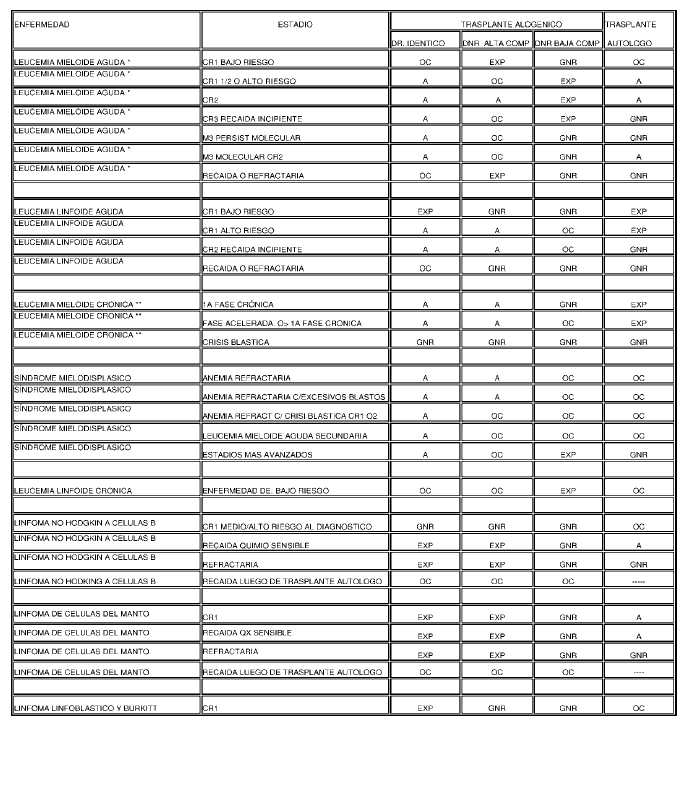
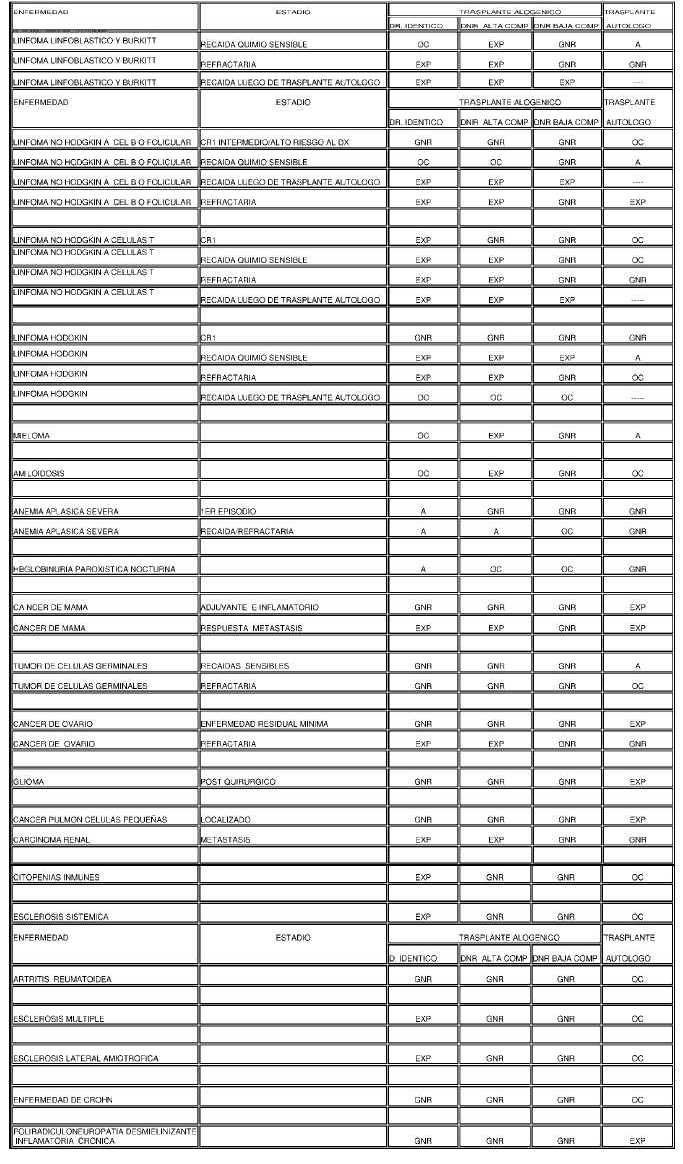
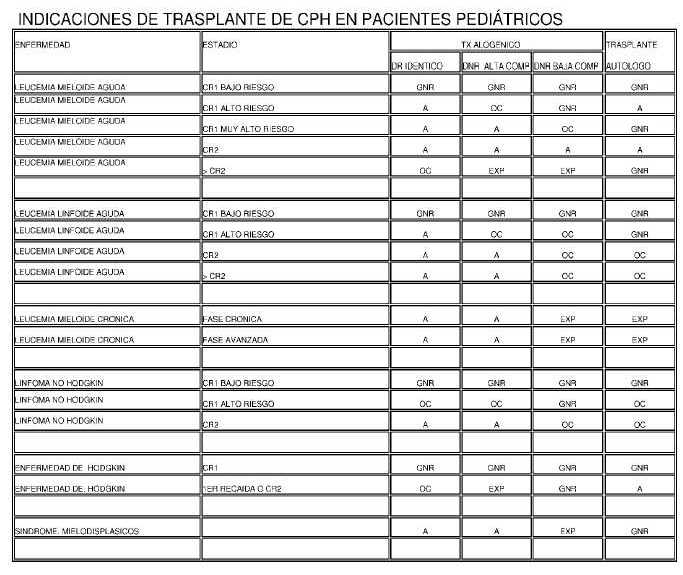
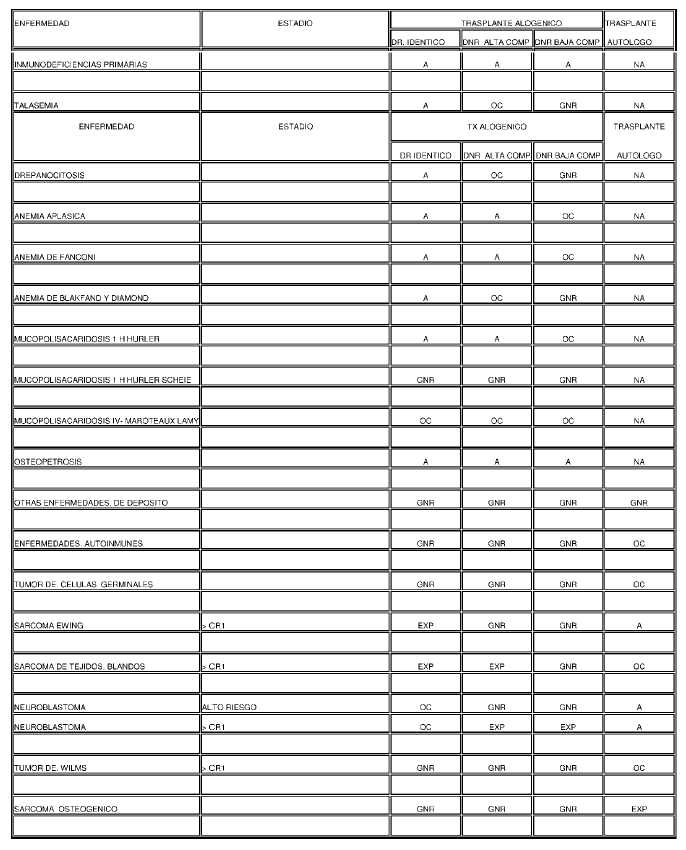
INDICACIONES DE TRASPLANTE DE CPH EN PACIENTES ADULTOS
ANEXO II
PROCEDIMIENTO APLICABLE PARA LA AUTORIZACION DE EMPLEO DE CPH EN INDICACIONES MEDICAS
Clínicamente Aprobada:
No requiere autorización previa. Los casos comprendidos en las Resoluciones INCUCAI Nº 119/ 04 y 319/04 deberán cumplimentar lo establecido en dichas normas.
Opción Clínica:
El equipo que solicita la aplicación de CPH deberá presentar el caso ante la Dirección Científico Técnica, quien luego de abrir el correspondiente expediente consultará al Registro de Donantes de Células Progenitoras Hematopoyéticas y como mínimo a cinco integrantes de la Comisión Asesora referida en el artículo 3º de la presente norma. El Directorio del INCUCAI será la autoridad competente para resolver la cuestión planteada.
Experimental:
Se procederá conforme a lo establecido en el artículo 2º del Decreto Nº 512/95, reglamentario de la Ley Nº 24.193.
Generalmente no recomendada:
No está autorizada la realización del implante en dicha indicación.
Referencias:
CR1, 2, 3: Primera, segunda o tercera remisión completa
DR. Idéntico: donante relacionado idéntico
DNR ALTA COMP: Donante no relacionado con alta compatibilidad
DNR BAJA COMP: donante no relacionado con baja compatibilidad
* Se deberá acreditar que la edad del paciente está dentro de los límites que permite su ejecución.
** Se deberá evaluar previo a la indicación del trasplante la respuesta al tratamiento convencional con inhibidores de tirosinkinasa.
En todos los casos la determinación del grado de compatibilidad del receptor con el donante no relacionado se hará de común acuerdo con el Registro Nacional de Donantes de Células Progenitoras Hematopoyéticas y cuando existiera divergencia de opiniones se llevará a cabo la consulta a la Comisión Asesora.
Cuando el donante alogénico relacionado no fuera el hermano, también se requerirá la consulta a la Comisión Asesora, para lo cual el equipo tratante deberá presentar ante la Dirección Científico Técnica, resumen de Historia Clínica y protocolo de inmunosupresión que se llevará a cabo.
En el caso de Trasplante con unidades de sangre de cordón de donantes no relacionados se tomará el mismo criterio que para el resto de los trasplantes alogénicos con donantes no relacionados, pero podrá ser evaluada la compatibilidad con seis antígenos (A, B y DR).