MINISTERIO DE SALUD
SECRETARÍA DE POLÍTICAS, REGULACIÓN E INSTITUTOS
ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
Disposición 6516/2015
Bs. As., 13/08/2015
VISTO la Ley N° 16.463, la Resolución del ex Ministerio de Salud y
Ambiente N° 20/05, la Resolución del Ministerio de Salud de la Nación
N° 627/07, las Disposiciones ANMAT Nros. 4980/05 y 2845/11 y el
Expediente N° 1-47-0000-007313-15-8 del Registro de esta Administración
Nacional de Medicamentos, Alimentos y Tecnología Médica, y
CONSIDERANDO:
Que toda política sanitaria debe tender al cuidado de la salud, a
través de procedimientos que regulen la publicidad y promoción de los
productos sujetos a vigilancia sanitaria, de modo tal que se garantice
su empleo seguro y eficaz para toda la población.
Que en ese entendimiento, la Resolución del ex Ministerio de Salud y
Ambiente N° 20/05 actualizó la normativa aplicable en materia de
publicidad de los productos cuya fiscalización se encuentra en la
órbita de esta ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y
TECNOLOGÍA MÉDICA (ANMAT).
Que asimismo en dicha resolución, se manifiesta que el poder de policía
sanitaria en esta materia corresponde a la ADMINISTRACIÓN NACIONAL DE
MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA en el ámbito de la
jurisdicción nacional y el tráfico interprovincial, en virtud de los
deberes y facultades acordados por el Decreto N° 1490/92.
Que el artículo 2° de la mencionada norma establece que “Toda
publicidad o propaganda dirigida al público de los productos
mencionados en el artículo 1° de la presente resolución, estará sujeta
a la fiscalización posterior a su difusión, de acuerdo al sistema que
la Administración Nacional de Medicamentos, Alimentos y Tecnología
Médica oportunamente establezca, según el medio en que la publicidad se
efectúe”.
Que el artículo 3° de la mencionada resolución establece como autoridad
de aplicación a esta ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS
Y TECNOLOGIA MÉDICA facultándola a dictar las normas reglamentarias,
aclaratorias e interpretativas que resulten necesarias a los fines de
su implementación.
Que en el cumplimiento de lo dispuesto en la aludida resolución, por
Disposición ANMAT N° 4980/05, se establecieron las normas generales y
específicas que debe cumplir toda publicidad dirigida al público en
general de cualquiera de los productos enumerados en la Resolución ex
M.S. y A. N° 20/05.
Que por otra parte, por Resolución del Ministerio de Salud N° 627/07 se
aprobaron las Buenas Prácticas de Promoción de Medicamentos de Venta
Bajo Receta, para los laboratorios productores, aplicables en materia
de la promoción destinada a los profesionales facultados para
prescribir o dispensar medicamentos con dicha condición de venta.
Que en este sentido, las publicidades y/o promociones de productos
sujetos a vigilancia sanitaria, deben propender a que los pacientes
reciban la medicación adecuada a sus necesidades clínicas, en las dosis
correspondientes a sus requisitos individuales, durante un período de
tiempo adecuado y al menor coste posible para ellos y para la comunidad
(Uso Racional de Medicamentos - OMS, 1985).
Que resulta necesario fortalecer el monitoreo y la fiscalización de la
publicidad de los productos sujetos a vigilancia sanitaria, para
garantizar que la información provista sea veraz y objetiva, con el fin
de que no induzca a errores de comprensión ni de lugar a promociones
engañosas o que predispongan a conductas y/o hábitos no saludables.
Que por Disposición ANMAT N° 2845/11 se creó el “Programa de Monitoreo
y Fiscalización de Publicidad y Promoción de Productos Sujetos a
Vigilancia Sanitaria”.
Que, entre las funciones del mencionado Programa se encuentra la de
evaluar las publicidades emitidas en medios masivos de comunicación que
correspondan a cualquiera de los productos incluidos en el artículo 1°
de la Resolución del ex Ministerio de Salud y Ambiente N° 20/05 y en
medios especializados donde se promocionen los productos incluidos en
la Resolución del Ministerio de Salud de la Nación N° 627/07, a los
fines de verificar el cumplimiento de la normativa vigente en la
materia.
Que es función del programa, asimismo, realizar las notificaciones a
los responsables de las publicidades que se considerasen emitidas en
presunta infracción a la normativa, a fin de que cesen en las conductas
violatorias, sin perjuicio de las demás acciones que pudieran
corresponder.
Que la normativa señalada se ha dictado fundamentalmente con el fin de
evitar que los consumidores, prescriptores y/o dispensadores tomen
decisiones equivocadas basadas en afirmaciones falsas o engañosas sobre
las propiedades y características de un determinado producto.
Que el avance de los nuevas estrategias promocionales, al que tienen
acceso en gran medida la población en general, dispensadores y
prescriptores complejiza aún más el escenario comunicacional generando
la necesidad de un monitoreo más amplio y coordinado.
Que resulta necesario reducir la brecha temporal entre la primera
emisión de la publicidad y/o promoción y la fiscalización por parte del
Organismo, a fin de garantizar que la información brindada sea adecuada
a la normativa vigente, siendo veraz, precisa y clara; con el fin de
propender a la utilización adecuada del producto, presentando sus
propiedades objetivamente sin engaños o equívocos.
Que ello permitirá actuar con mayor celeridad para notificar la
abstención de toda pauta publicitaria en presunta infracción a la
normativa.
Que dentro de este objetivo resulta conveniente implementar un
procedimiento de notificación obligatoria que fortalezca el monitoreo
de los mensajes publicitarios y/o promocionales de los productos
sujetos a vigilancia sanitaria, logrando una mayor eficiencia y
eficacia en la labor de fiscalización posterior.
Que en el escenario actual de los mensajes en la publicidad de los
productos sujetos a vigilancia sanitaria, esta Administración considera
que es de máxima importancia que la población reciba un mensaje claro y
veraz acerca de las características del producto publicitado, con la
finalidad de contribuir al empoderamiento a través del derecho de la
población a tomar decisiones a partir de información fidedigna en un
todo de acuerdo con lo establecido por el artículo 42 de la
CONSTITUCIÓN NACIONAL.
Que la DIRECCIÓN RELACIONES INSTITUCIONALES Y REGULACIÓN PUBLICITARIA,
la DIRECCIÓN GENERAL DE ADMINISTRACIÓN y la DIRECCIÓN GENERAL DE
ASUNTOS JURÍDICOS han tomado la intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por el Decreto N° 1490/92 y el Decreto N° 1886/14.
Por ello,
EL ADMINISTRADOR NACIONAL DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
ARTÍCULO 1° — Establécese que las empresas titulares de productos
sujetos a vigilancia sanitaria deberán notificar a esta ADMINISTRACIÓN
NACIONAL toda publicidad (tradicional o no tradicional) dirigida a la
población en general y presentar la pieza publicitaria correspondiente
en el formato que será difundida, cuando se trate de publicidades de
las siguientes categorías:
a) especialidad medicinal de venta libre;
b) productos alimenticios;
c) suplementos dietarios;
d) productos cosméticos, para la higiene personal y perfumes;
e) productos domisanitarios indicados en el art. 7° de la Disposición ANMAT N° 4980/05.
f) dispositivos de tecnología médica/productos médicos y productos
odontológicos indicados en el artículo 9° de la Disposición ANMAT N°
4980/05.
g) productos para diagnóstico de uso “in Vitro” para autoevaluación
contemplados en el artículo 11° de la Disposición ANMAT N° 4980/05;
(Nota Infoleg: por art. 1° de la Disposición N° 9660/2016
de la Administración Nacional de Medicamentos, Alimentos y Tecnología
Médica B.O. 31/8/2016 se deja sin efecto el sistema de notificación de
publicidad dirigida al público en general establecido en el presente
artículo. Vigencia: a los NOVENTA
(90) DÍAS CORRIDOS contados a partir del primer día hábil siguiente al
de su publicación en el Boletín Oficial.)
ARTÍCULO 2° — Establécese que las empresas titulares de los
medicamentos de condición de venta bajo receta deberán notificar a esta
ADMINISTRACIÓN NACIONAL la promoción de medicamentos dirigidos a los
profesionales de la salud junto con la pieza promocional
correspondiente en el formato que será difundida.
ARTÍCULO 3° — La notificación prevista en los artículos 1° y 2° de la
presente tendrá carácter de declaración jurada, se realizará en el
sistema de gestión electrónica con firma digital, a través del sitio
web institucional www.anmat.gov.ar, mediante un usuario y una clave
otorgada por la Dirección de Informática de la Dirección General de
Administración. En caso de ya poseer usuario y clave, se utilizará para
este trámite.
ARTÍCULO 4° — La declaración jurada deberá estar firmada por el
Representante legal o apoderado y Director Técnico, y ser acompañada
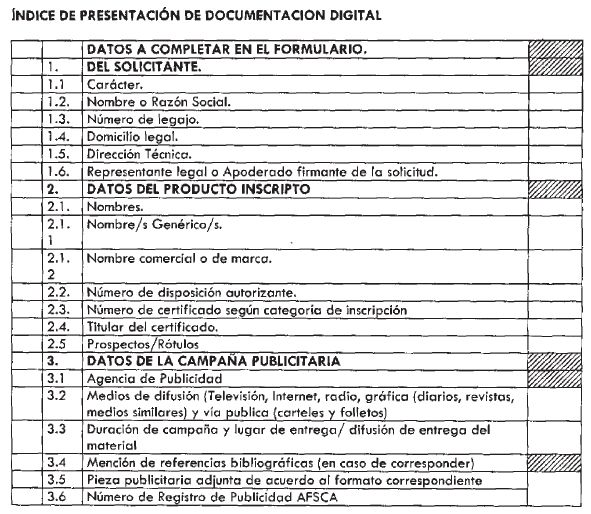
con los datos y documentación detallada en el Anexo I que forma parte
integrante de la presente disposición.
ARTÍCULO 5° — La notificación de publicidad y promoción debe realizarse
dentro de las 48 (cuarenta y ocho) horas a contar desde el inicio de la
difusión del material en cuestión,
ARTÍCULO 6° — La publicidad gráfica deberá ser presentada en extensión
.pdf/jpg y no exceder los 2MB: la pieza audiovisual deberá ser en .mp4
y no exceder 5 MB; la pauta radial deberá ser en .mp3/mp4 y no exceder
5 MB.
ARTÍCULO 7° — En caso de presunta infracción a la normativa vigente en
materia publicitaria, esta ADMINISTRACIÓN NACIONAL cursará las
intimaciones pertinentes a las empresas titulares de los productos a
fin de que cesen la difusión de la publicidad y/o promoción
involucrada, procediendo a la inclusión de dichas intimaciones en el
sitio web institucional, sin perjuicio de las demás acciones que
pudieran corresponder.
ARTÍCULO 8° — Cada nueva campaña que utilice la misma pieza
publicitaria o promocional debe ser notificada a esta ADMINISTRACIÓN
NACIONAL en los términos del art. 1° y 2° de la presente disposición.
ARTÍCULO 9° — De acuerdo con el artículo 5° de la Resolución del ex
Ministerio de Salud y Ambiente N° 20/05 las infracciones a lo dispuesto
en la presente Disposición, harán pasible al titular del producto y a
su director técnico, cuando corresponda, de las sanciones previstas en
las Leyes Nros. 16.463 y N° 18.284 y el Decreto N° 341/92.
ARTÍCULO 10. — La presente disposición entrará en vigencia a los 30
días contados a partir del día siguiente al de su publicación en
Boletín Oficial.
(Nota Infoleg:
por Circular N° 10/2015 de la Administación Nacional de Medicamentos,
Alimentos y Tecnología Médica B.O. 1/10/2015 se comunica a las empresas
titulares de productos sujetos a vigilancia
sanitaria alcanzados por la presente Disposición, la prórroga de su
entrada en
vigencia hasta el día 15 de octubre de
2015)
ARTÍCULO 11. — Regístrese; notifíquese a CAEME, CILFA, CAPGEN,
COOPERALA, CAPRODI, ALPHA, CADEA, CAPA, CAFADYA, CIPA, COPAL, CAPEMVel,
CARFIN, CACID, CADIEM. Dése a la Dirección Nacional del Registro
Oficial para su publicación. Cumplido, archívese. — Ing. ROGELIO LOPEZ,
Administrador Nacional, A.N.M.A.T.
ANEXO I
e. 20/08/2015 Nº 136471/15 v. 20/08/2015