

Servicio Nacional de Sanidad y Calidad Agroalimentaria
SANIDAD ANIMAL
Resolución 156/2002
Sistema Nacional de Seguimiento y Control de Hormonas Anabolizantes Administradas por Implante Subcutáneo. Identificación de los animales tratados. Documentación de seguimiento comercial de los mencionados implantes. Señal identificatoria para animales inplantados.
Bs. As., 15/2/2002
VISTO el expediente Nº 19.177/2001, las Resoluciones Nros. 369 del 28 de diciembre de 1998, 1994 del 10 de noviembre de 2000, 441 del 4 de octubre de 2001, todos del registro del SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA, y
CONSIDERANDO:
Que los titulares de los Certificados de Uso y Comercialización de los productos mencionados, presentaron diversas propuestas a consideración del Organismo, de acuerdo a lo establecido en el artículo 8º de la Resolución SENASA Nº 441/2001.
Que evaluadas las mismas por funcionarios de la Dirección Nacional de Sanidad Animal y de la Dirección de Agroquímicos, Productos Farmacológicos y Veterinarios, se concluyó que, con las modificaciones que se consideraron pertinentes, se podría autorizar el sistema propuesto otorgando un plazo razonable para su implementación.
Que la propuesta final fue analizada por demás áreas competentes del SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA, no realizándose observaciones a la misma.
Que a fin de implementar el Sistema de Seguimiento y Control de hormonas anabolizantes administradas por implante subcutáneo, se hace necesario introducir modificaciones en las Resoluciones Nros. 369 del 28 de diciembre de 1998 y 1994 del 10 de noviembre de 2000.
Que la Dirección de Asuntos Jurídicos ha tomado la intervención que le compete.
Que el suscripto es competente para el dictado del presente acto, en virtud de las facultades conferidas por el artículo 8º, inciso n) del Decreto Nº 1585 de fecha 19 de diciembre de 1996, sustituido por su similar Nº 394 del 1º de abril de 2001.
Por ello,
EL PRESIDENTE DEL SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA
RESUELVE:
Artículo 1º — Apruébase el "Sistema Nacional de Seguimiento y Control de Hormonas Anabolizantes Administradas por Implante Subcutáneo" para su comercialización, y uso que como Anexo I forma parte de la presente Resolución.
Art. 2º — El SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA evaluará, a partir de los CIENTO OCHENTA (180) días, contados a partir de la publicación de la presente resolución en el Boletín Oficial, el grado de implementación del Sistema mencionado en el artículo precedente. Si como resultado de esa evaluación, se constatase que no se ha logrado un grado sustancial de cumplimiento en la implementación del mismo, el SENASA podrá proceder a la suspensión de los Certificados de Uso y Comercialización de los productos anabolizantes hormonales por implante subcutáneo.
(Nota Infoleg: Por art. 1° de la Resolución N° 266/2003 del Servicio Nacional de Sanidad y Calidad Agroalimentaria B.O. 2/12/2003 se suspende por el término de CIENTO OCHENTA (180) días en el Registro Nacional correspondiente, la validez de los certificados de uso y comercialización de los productos hormonales anabilizantes que se administren por implante subcutáneo de uso en medicina veterinaria. Vigencia: a partir de la fecha de su publicación en el Boletín Oficial.)
Art. 3º — Establécese que el diseño de la señal identificatoria de los animales implantados es el de Trébol de tres hojas, cuyo modelo obra como Anexo II de la presente resolución.
Art. 4º — Sustitúyese el artículo 4º de la Resolución Nº 369 del 28 de diciembre de 1998 del SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA el que quedará redactado de la siguiente forma: "ARTICULO 4º — Las distribuidoras y expendedoras veterinarias deberán llevar un archivo que deberá contener: Remitos y facturas de compra de los productos previstos en el Artículo 1º— de la presente resolución y los documentos de venta, remito o factura y, en caso de venta a usuario final, el original de la Receta Oficial Archivada.".
Art. 5º — Sustitúyese el artículo 3º de la Resolución Nº 1994 del 10 de noviembre de 2000 del SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA, el que quedará redactado de la siguiente manera: "ARTICULO 3º — Las Recetas Oficiales deberán estar numeradas en forma correlativa, presentarse por triplicado, impresas de forma tal que impidan su duplicación o falsificación y contendrán, como mínimo, la siguiente información: fecha; nombre del producto veterinario expendido; principio activo; presentación; dosis; especie; número de animales a tratar; sexo; edad y peso del/ los destinatario/s; número de REGISTRO NACIONAL SANITARIO DE PRODUCTORES AGROPECUARIOS (RENSPA) o nombre y domicilio del dueño del o de los animales, según corresponda; firma, aclaración y número de matrícula del profesional actuante, así como todo otro dato que se considere pertinente. En el caso de recetas oficiales utilizadas para indicar productos hormonales o anabolizantes indicados para animales productores de alimentos para consumo, podrán omitirse los datos correspondientes a sexo, edad y peso del destinatario, siendo obligatorio consignar el número de RENSPA.
En el duplicado y el triplicado de la Receta Oficial Archivada (ROA), deberá constar el siguiente texto: "Certifico que se ha procedido a realizar el implante de acuerdo a lo prescrito en la presente Receta Oficial. Asimismo, certifico que los animales implantados están identificados con la señal prevista en la Resolución SENASA Nº .........., que individualiza a los animales que han recibido tratamiento hormonal anabolizante".
El profesional Veterinario que rubrica la Receta Oficial Archivada (ROA), que prescribe tratamientos hormonales anabolizantes, deberá hacer llegar el duplicado de la ROA a la Oficina Local del SENASA que corresponde al establecimiento en el que se ha realizado el tratamiento".
Art. 6º — Prohíbese, en todo el Territorio Nacional, la administración, a los animales productores de alimentos destinados a consumo humano, de anabolizantes hormonales que se apliquen en forma inyectable. Practíquense las modificaciones necesarias en los Certificados de Uso y Comercialización oportunamente otorgados por este Servicio Nacional con relación a dichos productos.
Art. 7º — Las cajas o estuches que contengan a los productos anabolizantes hormonales por implante subcutáneo, deberán poseer una parte de su superficie fácilmente removible (troquelada, perforada) en la que conste nombre comercial del producto y número de serie o lote. Acompañando a la presentación comercial del producto deberá incluirse etiquetas autoadhesivas, numeradas del UNO (1) al número total de dosis contenidas en el envase; en cada una de ellas deberá constar el nombre comercial del producto y número de serie o lote.
Art. 8º — El incumplimiento de lo establecido en la presente resolución, dará lugar a la aplicación de las sanciones previstas en el artículo 18 del Decreto Nº 1585 del 19 de diciembre de 1996.
Art. 9º — Comuníquese, publíquese, dése a la Dirección Nacional del Registro Oficial y archívese. — Bernardo G. Cané.
ANEXO I
SISTEMA NACIONAL DE SEGUIMIENTO Y CONTROL DE HORMONAS ANABOLIZANTES ADMINISTRADAS POR IMPLANTE SUBCUTANEO
IDENTIFICACION PERMANENTE DE ANIMALES TRATADOS
Objetivos Generales
Instaurar un sistema de seguimiento, control y auditoría de la totalidad de las dosis de implantes hormonales elaboradas y utilizadas en la ganadería, asegurando su exclusión de los establecimientos inscriptos para faena a la Unión Europea (UE).
Objetivos específicos
Ejecutar un sistema de seguimiento, control y verificación de la totalidad de los animales que han sido tratados con hormonas anabolizantes administradas por implante subcutáneo.
Auditar técnica y administrativamente la totalidad de las acciones, en el ámbito nacional, con respecto a la elaboración, venta y aplicación de implantes hormonales.
Estrategia
Adecuar los procedimientos previstos en la Resolución SENASA Nº 369/98, prosiguiendo el seguimiento de la comercialización hasta el usuario final por Resolución Nº 1994/2000, aplicando los implantes y señalando los animales tratados a través de la intervención del profesional proveedor de los implantes.
Acciones
Controlar la comercialización y aplicación de implantes conteniendo hormonas anabolizantes.
Identificar con una señal la totalidad de los animales que han recibido implantes conteniendo hormonas anabolizantes.
Garantizar que los animales existentes en los establecimientos inscriptos para faena para la UE, en toda su vida no han sido tratados con hormonas anabolizantes.
Auditar los establecimientos en los que se han efectuado implantes, a fin de verificar el procedimiento.
Verificar, previo a la faena para UE, que ningún animal se encuentra con la señal identificatoria de animal implantado.
Promover la concreción de convenios entre SENASA y los organismos competentes provinciales o entidades de los profesionales veterinarios, incluyendo las Provincias de CHUBUT, NEUQUEN, RIO NEGRO, SAN JUAN, SAN LUIS y TIERRA DEL FUEGO, ANTARTIDA E ISLAS DEL ATLANTICO SUR.
Actualizar en forma permanente el registro de expendedores mayoristas y minoristas.
I. Seguimiento y Control de la Comercialización de anabólicos.
Cada titular de Certificado de Uso y Comercialización y cada comercializador inscripto deberá llevar un archivo en el que consten en forma completa los documentos de compra y de venta de implantes anabólicos.
La documentación debe ser conservada hasta DOS (2) años después de realizada cada operación.
A los fines de su auditoría oficial debe obrar copia de cada documento tanto en el archivo del emisor del mismo, (documento de salida o venta) como del receptor (documento de entrada o compra).
El documento a archivar será la Factura o, en su defecto, el Remito que documenta el movimiento de producto entre partes.
El movimiento de producto desde el comercio al usuario deberá ser documentado mediante Receta Oficial Archivada (ROA).
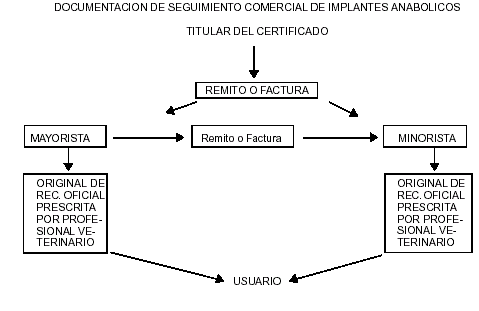
a. La Documentación Comercial del movimiento de anabólicos será archivada en el domicilio legal de cada operador (lugar formal de auditoría).
b. De acuerdo a las normas vigentes, sólo pueden efectuarse ventas desde los laboratorios elaboradores o importadores a comercializadores inscriptos, desde comercializadores inscriptos a otros comercializadores inscriptos o a usuario final.
c. La información que deben conservar los comercializadores será un archivo, el que contendrá, por un lado, los remitos o facturas de compra de anabolizantes y, por otro, los documentos de venta, remito o factura y, en caso de venta a usuario final, el original de la receta oficial archivada.
d. Cada comercialízador mayorista o minorista deberá informar a su proveedor mediante un listado, los números de remito o factura mediante los cuales vendieron los implantes anabólicos, indicando la cantidad de unidades de producto y de dosis comercializadas y stock remanente. Esta información debe ser presentada cada vez que, entre la última adquisición y la siguiente, hubieran transcurrido TREINTA (30) días o, si luego de una compra, transcurriera un período de CUATRO (4) meses sin movimiento.
e. En el caso de venta a usuario del producto, deberá constar, además, el Número de Receta Oficial Archivada (ROA) y la institución emisora de la receta.
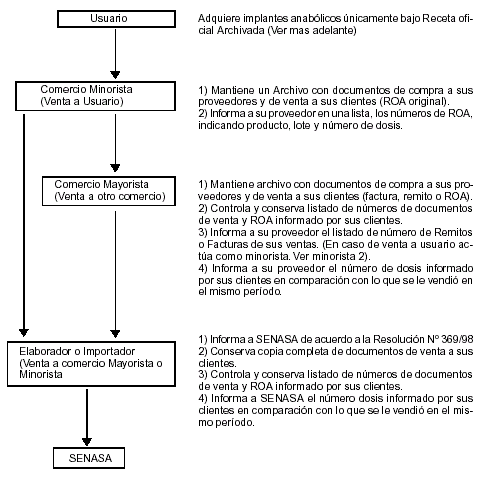
f. Transcurrido el plazo estipulado, cada proveedor (titular de Certificado de Uso y Comercialización o mayorista) receptor de la información detallada en el punto c., deberá a su vez informar a su proveedor o, en caso de ser titular de un certificado de uso y comercialización a SENASA, los números totales de documentos (facturas, remitos o ROA, según corresponda) y número de dosis informados por sus clientes en un listado que permita comparar las dosis totales vendidas a cada cliente y las dosis informadas mediante dichos documentos.
g. Toda la información descripta en los puntos b.; c; d. y e del presente Anexo, debe conservarse ordenada cronológicamente y a disposición del SENASA a los fines de la auditoría oficial del sistema.
h. Los titulares de Certificados de Uso y Comercialización darán aviso al SENASA cuando algún comercializador no presente la información necesaria puntualmente. Dichos comercializadores serán excluidos automáticamente del sistema a través del siguiente mecanismo: el SENASA comunicará a todos los titulares de Certificados de Uso y Comercialización la identificación del/los comercializador/ es suspendido/s e iniciará las acciones administrativas que correspondan.
i. Ante la detección de cualquier incumplimiento en el funcionamiento del sistema, el SENASA podrá suspender el Certificado de Uso y Comercialización del producto que corresponda. La conservación de documentos para auditoría oficial del sistema y el flujo de información para auditoría interna queda integrado de la siguiente forma:
II. Seguimiento de la aplicación de los implantes comercializados
a. Identificación Permanente y específica de los animales tratados
Se establece que los animales implantados serán identificados con una señal en forma de "trebol de tres hojas", disponible en el mercado, aplicada sobre el borde inferior de la oreja izquierda.
La señal debe generar una solución de continuidad en el borde de la oreja citada.
En el caso de que la oreja de un animal haya sufrido heridas traumáticas que dificulten la identificación, será considerado como animal tratado.
b. Responsabilidad del profesional que prescribe la aplicación de implantes anabólicos
Base legal: Resolución SENASA Nº 1994 del 10 de noviembre de 2000
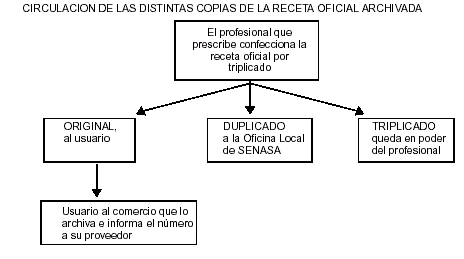
El duplicado y el triplicado de la ROA contendrán el siguiente texto: "Certifico que se ha procedido a realizar el implante de acuerdo a lo prescripto en la presente receta oficial. Asimismo, certifico que los animales implantados están identificados con la señal prevista en la Resolución SENASA Nº.........., que individualiza a los animales que han recibido tratamientos hormonales anabolizantes". La afirmación efectuada deberá ser rubricada por el profesional matriculado actuante.
El mismo profesional deberá hacer llegar el duplicado de la receta a la Oficina Local de SENASA que corresponde al establecimiento en el cual se ha realizado el tratamiento, a los efectos de entregar el duplicado y hacer sellar el triplicado para su posterior archivo.
El duplicado deberá presentar adherido el troquel que identifica al producto utilizado y el sticker correspondiente al número de dosis aplicadas por unidad de producto adquirido. De no utilizarse la totalidad de las dosis que conforman la unidad de producto, las restantes se rendirán ante la Oficina Local, cuando sean aplicadas, a través de una nota, con firma y sello aclaratorio del profesional actuante, que certifique la aplicación de las dosis remanentes de acuerdo a la normativa vigente. Este certificado será adjuntado a la receta oficial que fuera archivada en la Oficina Local, en la cual consta el troquel de la unidad de producto.
Para obtener un nuevo recetario oficial, los veterinarios deberán presentar, ante la institución emisora (Colegio, Consejo o SENASA), el total de los triplicados utilizados. Los correspondientes a implantes hormonales deberán presentar constancia de haber sido intervenidos por el SENASA.
Glosario de términos utilizados.
Titular del Certificado de Uso y Comercialización: Es la persona física o jurídica, inscripta en el SENASA, a nombre de la cual está registrado y extendido el correspondiente certificado de libre uso y comercialización.
Comercializador inscripto: Es la persona física o jurídica, inscripta y registrada en el SENASA, como distribuidor y/o expendedor de Productos Veterinarios.
Mayorista: Es la persona física o jurídica, inscripta y registrada en el SENASA, como distribuidor de Productos Veterinarios.
Minorista: Es la persona física o jurídica, inscripta y registrada en el SENASA, como expendedor (casa de expendio) de Productos Veterinarios.
Usuario:
Es el establecimiento inscripto con su correspondiente RENSPA, donde se aplica el producto.
Requerimientos normativos.
A) Definición de la señal; Formato y ubicación.
B) Control de despacho de animales con destino a faena para exportación a la UE - Controlar la ausencia de señal.
C) Comunicar a elaboradores, importadores y comercios mayoristas el listado de comercializadores inscriptos.
D) Poder de suspensión transitoria por vía administrativa de la condición de comercializador inscripto (plazo y condición de rehabilitación).
E) Mecanismo de comunicación de la suspensión a eventuales proveedores (Sistema rápido).
e. 26/2 Nº 377.415 v. 26/2/2002