ADMINISTRACION DE PROGRAMAS ESPECIALES
Resolución 5656/2004
Financiamiento y seguimiento de los beneficiarios VIH+ por quienes los Agentes de Salud hayan presentado solicitudes de subsidios o reintegros. Modifícanse las Resoluciones Nros. 475/2002 y 7800/2003, con la finalidad de actualizar la normativa vigente en relación con los avances en el tratamiento antirretroviral.
Bs. As., 11/6/2004
VISTO la Resolución Nº 475/02 de esta Administración de Programas Especiales, y
CONSIDERANDO:
Que mediante la Resolución citada en el VISTO fueron aprobadas las nuevas normas de financiamiento y seguimiento de los beneficiarios VIH+ por los que los Agentes de Salud hayan presentado solicitudes de subsidios o reintegros ante esta Administración de Programas Especiales.
Que los nuevos criterios establecidos por la norma obedecieron al avance del conocimiento científico sobre la materia, circunstancia que planteó la necesidad de adecuar las modalidades de tratamiento a las últimas incorporaciones en materia de conocimiento sobre la enfermedad y su tratamiento, a efectos de obtener una mejor calidad de vida de los pacientes.
Que es necesario continuar la senda encarada por la Resolución Nº 475/02 - APE manteniendo actualizada la norma respecto de los avances de la ciencia respecto al tratamiento antirretroviral.
Que en tal sentido fueron consultados distintos representantes de Organismos Gubernamentales y No Gubernamentales así como a las sociedades científicas y los propios prestadores.
Que el mercado farmacéutico ha desarrollado nuevas drogas de ineludible inclusión en la terapéutica.
Que la propia patología del virus hace frecuente la aparición de comorbilidades siendo una de las de mayor incidencia la Hepatitis C.
Que la experiencia ha demostrado que el abandono del tratamiento sin autorización del médico tratante es la principal causa de fallos terapéuticos haciendo conveniente imponer a los profesionales médicos la obligación de controlar la adherencia de los pacientes al tratamiento.
Que la Gerencia de Prestaciones de esta Administración ha efectuado un relevamiento de todos los expedientes del año 2003 relacionados con pacientes VIH+ cuyo resultado indica que los valores establecidos por la Resolución Nº 475/02 - APE superan los montos solicitados por los Agentes de Salud, por lo que concierne concertar nuevos montos que se ajusten a la realidad.
Que corresponde asimismo ajustar el valor del módulo de CD4 y Carga Viral e incorporar ambos junto con la adherencia en un nuevo módulo que unifique el valor de las tres prestaciones.
Que las adecuaciones a la Resolución Nº 475/02 - APE han sido efectuadas teniendo en cuenta la opinión de representantes de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, del Programa Nacional de Garantía de Calidad, del Programa Nacional de Lucha contra los Retrovirus de Humano VIH/SIDA y ETS del Servicio Penitenciario Federal, de la Sociedad Argentina de SIDA, de la Sociedad Argentina de Infectología y otros expertos en la materia.
Por ello, en uso de las atribuciones fijadas por los Decretos Nº 53/98 y 167/02,
EL INTERVENTOR DE LA ADMINISTRACION DE PROGRAMAS ESPECIALES
RESUELVE:
Artículo 1º Modifícase el Anexo I de la Resolución Nº 475/02 - APE el que quedará redactado conforme las pautas establecidas en el Anexo I de la presente.
Art. 2º Incorpórase como Anexo III de la Resolución Nº 475/02 - APE la Planilla de Adherencia que como Anexo II forma parte de la presente Resolución.
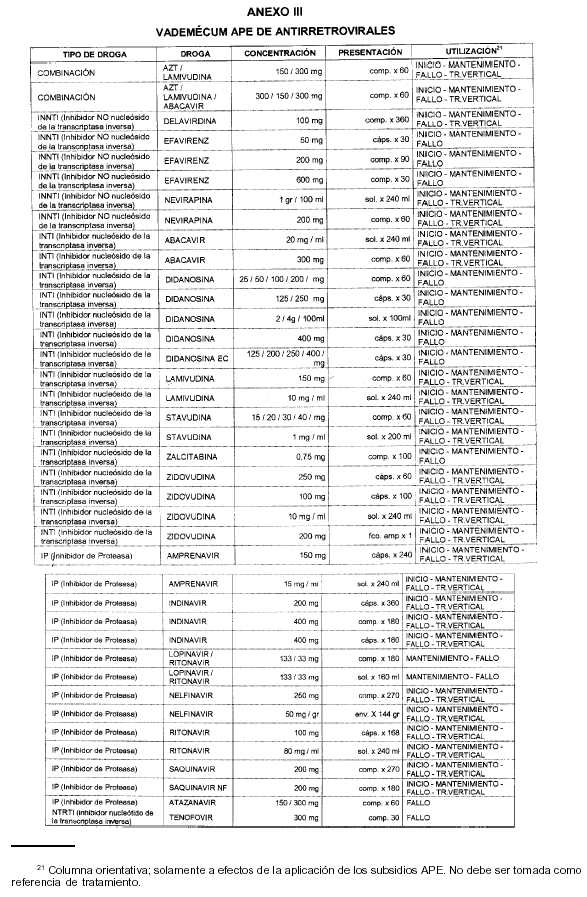
Art. 3º Incorpórase como Anexo IV de la Resolución Nº 475/02 - APE el Vademécum de Medicación Antirretroviral establecido por esta Administración de Programas Especiales que como Anexo III forma parte de la presente Resolución.
Art. 4º Modifícase el punto h.4 del apartado 1.1 del Anexo I de la Resolución Nº 7800/03 - APE, el que quedará redactado de la siguiente manera: "h.4) Para los tratamientos y prestaciones relativas al Virus de Inmunodeficiencia Adquirida (VIH):
h.4.a) Declaración Jurada conforme los términos establecidos en el Anexo V de la presente o Resumen de Historia Clínica al último mes del período otorgado por el expediente sujeto a rendición.
Toda la documentación mencionada en el punto h) deberá ser firmada y sellada por el médico auditor del Agente de Salud.
Las facturas o recibos de los medicamentos adquiridos deberán estar acompañados de sus correspondientes troqueles.".
Art. 5º Regístrese, comuníquese, publíquese, dése a la Dirección Nacional del Registro Oficial y oportunamente archívese. Eugenio D. Zanarini.
ANEXO I
MODULOS DE TRATAMIENTO HIV Y RECOMENDACIONES
Módulo 1 - BITERAPIA -: No aplicable a pacientes que inicien tratamiento. Sólo para casos históricos en que los resultados de Carga Viral Ultrasensible lo justifiquen, a efectos de no avalar tratamientos subóptimos.
|
Valor APE de referencia: hasta $ 600 |
I. MODULO DE TRATAMIENTO
MODO A: TRITERAPIA
|
Combinaciones |
|
2 INTI + 1 INNTI |
|
2 INTI + 1 IP (con Ritonavir como booster) 1 |
|
2 INTI + Nelfinavir |
|
2 INTI2 + Abacavir |
En caso de carga viral > 100.000 copias/ml se preferirá un esquema que contenga IP, EFV o NVP. En todos los pacientes con CD4 < 100 cel/ml y en aquellos con CD4 > 100 cel/ml, pero con CV >100.000 copias/ml se prefiere un esquema que contenga IP, EFV o NVP3.
Normas:
Iniciar tratamiento a todo paciente VIH + con enfermedad marcadora de SIDA, candidiasis oral o con síntomas sugestivos de enfermedad oportunista.
En casos de exposición accidental significativa de alto riesgo.
En embarazadas VIH +, independientemente del estadio de su enfermedad.
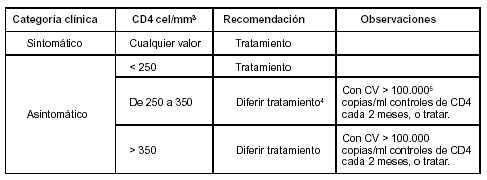
En pacientes asintomáticos la decisión se basa fundamentalmente en los niveles de carga viral y CD4.
MODO B: DE TRATAMIENTO SIMPLIFICADO
Fundamentos:
1- Mejoría, resolución o prevención de toxicidades
2- Mejoría de la adherencia
3- Mejoría de la calidad de vida
Objetivo
Mantener igual supresión virológica y mejoría inmunológica que la alcanzada con el tratamiento con IP.
Criterios de inclusión
Pacientes que recibieron HAART con IP por lo menos durante 9 meses y que al momento de realizar el cambio a INNTI o ABC (abacavir) tengan recuento de CD4 ³ 350 células y carga viral < 50 copias durante ³ 6 meses (en dos controles).
Alternativas de cambio6
1- Abacavir:
Pacientes que recibieron un solo esquema de tratamiento antirretroviral previo y un nadir de CD4 > 200 células/mm3.
2- Nevirapina o Efavirenz:
Pacientes sin fallo documentado a ninguno de los tratamientos previos, "naïve" de INNTI y con cualquier nadir de CD4.
3- Nevirapina:
En coinfección con HCV:
- Con transaminasas normales: si se realiza cambio a NVP realizar TGO y TGP mensualmente durante los primeros 3 meses del inicio de NVP, por el riesgo aumentado de hepatitis tóxica en este grupo de pacientes.
- Con transaminasas ³ a 3,5 veces su valor normal, no se recomienda.
4- Nevirapina y Efavirenz:
Evitar en pacientes con transaminasas ³ 5 veces su valor normal. Considerar ABC.
5- Efavirenz:
Evitar en pacientes que presenten alteraciones del SNC.
Evitar si el trastorno metabólico es predominantemente hipertrigliceridemia.
6- Para la presentación del expediente se solicitarán las documentaciones exigidas por la normativa 001/98, respetando la solicitud semestral de tratamiento y por el mismo período de tiempo, hasta un máximo de 10 (DIEZ) pacientes por presentación.
|
Valor APE de referencia: hasta $ 1.260 |
1
Esta combinación no se considera Mega-HAART al utilizarse como inicio de tratamiento.2
Aplicable a AZT + 3TC3
La nevirapina debe ser usada con prudencia en mujeres naïve con cd4 >2504
En caso de diagnóstico de primoinfección: se sugiere iniciar tratamiento (controversial; analizar cada caso en particular).5
Por RT-PCR, NASBA o b-DNA versión 3.0.6
A mayor exposición previa a drogas, mayor probabilidad de fallo luego del cambio.II. MODULO DE TRATAMIENTO DE EMBARAZO
A) MODULO DE TRANSMISION VERTICAL
La mujer HIV+ embarazada debe ser tratada con los mismos criterios que una mujer HIV+ NO embarazada, con excepción de las drogas contraindicadas para el embarazo (Efavirenz, Hydroxiurea). Las embarazadas que no requirieran tratamiento por su propio beneficio deben recibir como mínimo el régimen PACTG076. Muchos expertos aconsejan utilizar tres drogas también en esta situación.
1- Gestante:
Antes del Parto: Inicio a las 14 - 34 semanas de gestación.
i. Régimen PACTG 076: ZDV 100 mg 5 veces por día.
ii. Alternativa aceptable: ZDV 200 mg 3 veces al día o
iii. ZDV 300 mg 2 veces al día.
Intraparto: ZDV 2 mg/kg IV durante 1 hora, seguidos por infusión continua de 1 mg/kg IV hasta finalización del parto.
Controles: Ver Anexo II
2- Neonato: ZDV 2mg/Kg VO cada 6 horas durante primeras 6 semanas de vida, comenzando entre 1 y 8 horas después del nacimiento.
Controles: 2 PCR, 1 a los 30 días y otro al 3º mes o según opinión médica.
|
Valor APE de referencia: hasta $ 1.700 |
B) OTRAS OPCIONES (se agrega sólo con fines informativos científicos. La APE no subsidiará este tipo de terapéutica)
Mujer VIH positiva en trabajo de parto que no ha recibido tratamiento previo, se puede considerar el siguiente régimen:
Una dosis de 200 mg de nevirapina en el comienzo del trabajo de parto y una dosis de nevirapina suspensión a las 48 hs. de vida al recién nacido (2 mg/k/dosis).
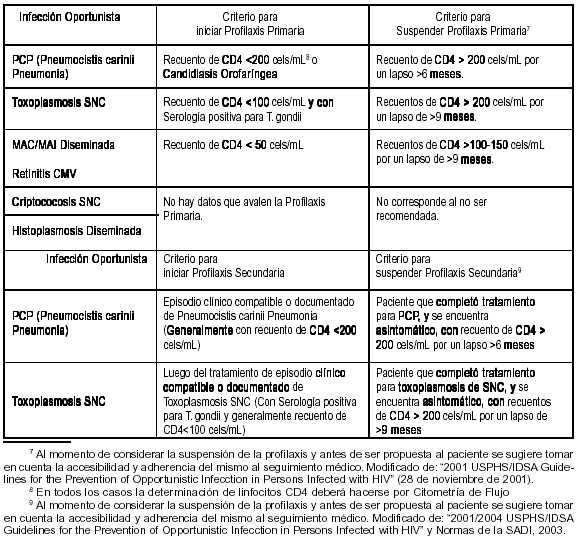
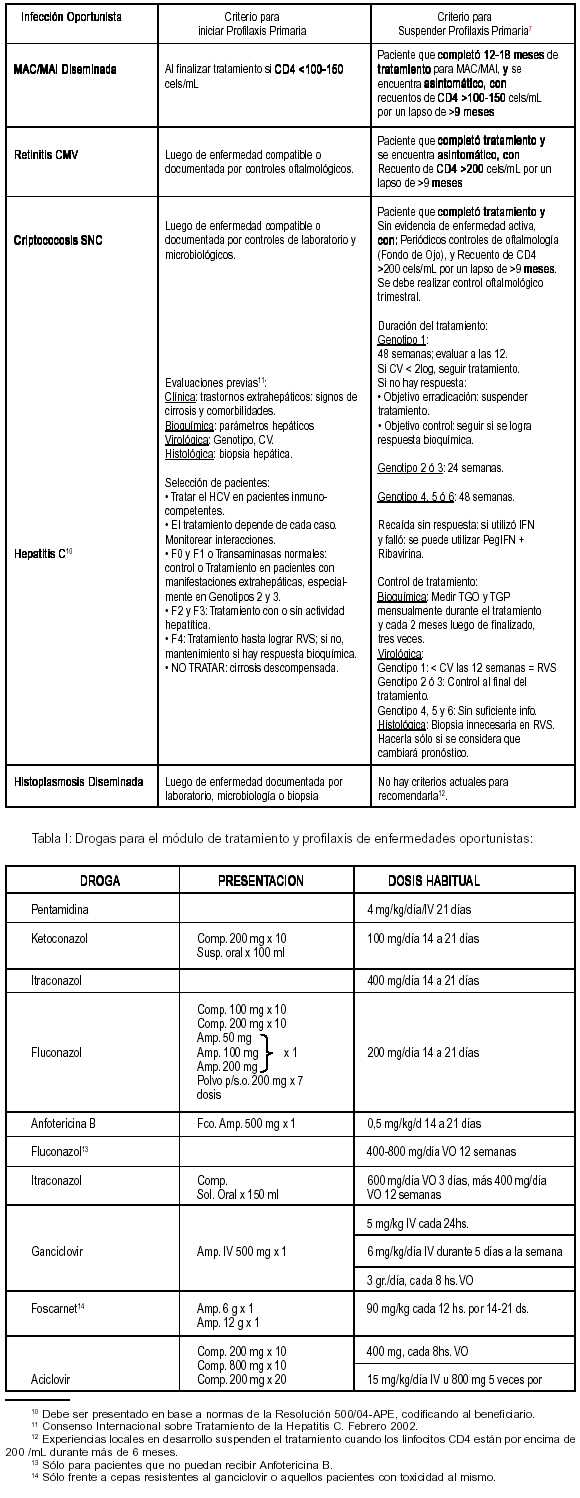
III. MODULO DE TRATAMIENTO Y PROFILAXIS DE ENFERMEDADES OPORTUNISTAS
1- Módulo compuesto por antivirales no antirretrovirales, antibióticos y quimioterápicos, utilizados aisladamente o en cualquier combinación. Las drogas a utilizar son las establecidas en el apartado A, Tabla I del presente anexo.
2- Este módulo se incorporará o retirará del tratamiento según necesidades. La Obra Social podrá solicitarlo aun en casos de subsidios vigentes por módulos de antirretrovirales. Estos casos se tratarán por cuerda separada del subsidio por tratamiento base y la Obra Social deberá informar de tal circunstancia en todos los casos. Los expedientes deberán incorporar la documentación requerida para la presentación de subsidios y/o reintegros por módulo de tratamiento, más la historia clínica médica que justifique la incorporación o suspensión del módulo. El mismo tendrá una duración mínima de 6 (SEIS) meses y una máxima de 10 (DIEZ) meses, de acuerdo a la patología ver cuadros; en ambos casos, de extenderse dicha cobertura se deberá avalar con la documentación pertinente que lo justifique. Los criterios de incorporación y suspensión de tratamiento son los siguientes:
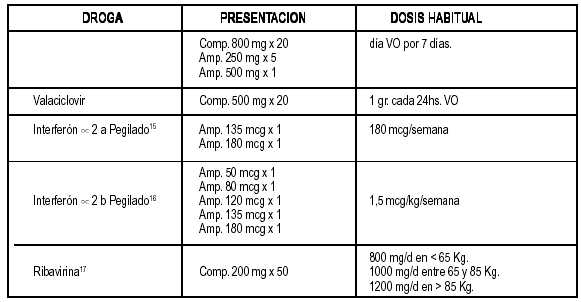
|
Valor APE de referencia: hasta $ 250 |
IV. MODULO DE FALLO
1. PRINCIPIOS
1.1. El fallo en alcanzar y mantener una carga viral no detectable durante la terapia antirretroviral promueve la resistencia a los antivirales, compromete futuras opciones de tratamiento y posiblemente, aumenta la transmisión del HIV en la comunidad.
1.2. El fallo virológico predispone al fallo inmunológico y eventualmente a la progresión de la inmunodeficiencia.
1.3. La detección y tratamiento precoz del fallo virológico favorece la respuesta al tratamiento de rescate.
1.4. Ante la falta de opciones terapéuticas documentada por la historia de tratamiento y resistencia in vitro a múltiples drogas puede optarse por un tratamiento no supresivo de la carga viral.
1.5. El fallo virológico aislado, en ninguna circunstancia, es una causa para discontinuar el tratamiento antirretroviral.
2. DEFINICIONES DE FALLO VIROLOGICO
2.1. Fallo en reducir la carga viral en un (1) logaritmo a las 8-12 semanas de iniciado el tratamiento.
2.2. Fallo en reducir la carga viral a niveles no detectables a las 24 semanas de iniciado el tratamiento.
2.3. Aumento confirmado de la carga viral superior a las 5000 copias/ml luego una respuesta inicial
3. CAUSAS DE FALLO VIROLOGICO
3.1. Existen múltiples causas de fallo virológico, entre ellas las más frecuentes son:
adherencia subóptima
intolerancia y toxicidad
interacciones medicamentosas
una o más de las anteriores permiten la replicación viral en presencia de concentraciones subóptimas de drogas y la consiguiente selección de variantes virales resistentes.
4. GUIA PARA EL TRATAMIENTO DEL FALLO VIROLOGICO
4.1. Identificación y corrección de la/s causa/s predisponentes.
4.2. Confirmar con una segunda carga viral que muestre valores superiores a las 5.000 copias/ml con un intervalo no menor a los 15 días mientras el paciente recibe más del 90% de las dosis indicadas.
4.3. Seleccionar un nuevo tratamiento (ver guía en la tabla adjunta).
Tabla II. GUIA DE TRATAMIENTO PARA EL FALLO TERAPEUTICO
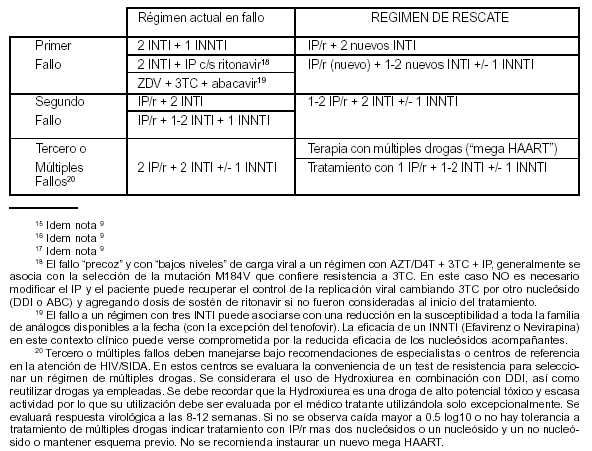
Combinaciones de inhibidores de la proteasa con sostén de ritonavir recomendadas:
Saquinavir 1000 mg + Ritonavir 100 mg cada 12 hs
Saquinavir 1600 mg + Ritonavir 100 / 200 mg cada 24 hs
Indinavir 800 mg + Ritonavir 100-200 mg cada 12 hs
Amprenavir 600 mg + Ritonavir 100 mg cada 12 hs
Lopinavir/r 300 mg (400 mg en combinación con NVP o EFV) cada 12 horas.
5. La Administración de Programas Especiales sólo subsidiará dentro de este módulo aquellos tratamientos con cuatro o más drogas indicados luego del segundo fallo con esquemas terapéuticos con múltiples drogas ("HAART"). Las combinaciones de tres (3) drogas más Ritonavir como booster, serán consideradas dentro de este módulo. No se tomarán en cuenta las mono y biterapias previas a los HAART en cuestión. En todos los casos se deberá presentar el expediente en forma individualizada, con la documentación requerida para la presentación de subsidios y/o reintegros por módulo de tratamiento, más el agregado de una historia clínica detallada donde se identifiquen las causas del fallo, últimos dos tratamientos realizados y últimas tres determinaciones de carga viral y cd4.
|
Valor APE de referencia: hasta $ 2.700 |
V. MODULO DE ADHERENCIA Y SEGUIMIENTO:
El objetivo de la TARV, es lograr la supresión duradera de la replicación viral. Una de las formas para conseguir efectivamente esto es a través de la adherencia estricta al tratamiento evitando de esta manera la resistencia a las distintas drogas y la utilización de terapias de rescate más complejas para el paciente que al mismo tiempo generan mayores costos y una mala utilización de los escasos recursos terapéuticos existentes.
El término de adherencia se ha utilizado para definir una conducta comprometida del paciente hacia el tratamiento y aunque distintas variables sean las que definan el éxito global de la terapéutica, esto, más una buena relación entre todos los miembros del equipo de salud definen los componentes del éxito.
La adherencia se ha instalado como tema central dentro del planteo general del tratamiento para HIV/SIDA, por eso y de acuerdo con los lineamientos internacionales se incorpora a la normativa vigente el tema de la adherencia al tratamiento ARV.
APE, no subsidiará ni reintegrará aquellos tratamientos considerados subóptimos, interrumpidos o discontinuados sin causa justificada.
A tal efecto cada prestador deberá incorporar en sus lugares de atención programas de adherencia a fin de generar un mejor cumplimiento en el tratamiento ARV en sus pacientes.
En los casos en donde la prestación sea por menos de seis meses o cuando dentro de un semestre se solicite subsidio o reintegro por tratamiento por menor tiempo, la auditoría médica deberá presentar un informe detallando el porqué de la menor prestación. Se actuará del mismo modo en los casos en que el beneficiario haya abandonado su tratamiento y seguimiento, adjuntándose en este particular un informe detallado sobre lo ejecutado por la peticionante a fin de reintroducir al beneficiario al tratamiento instituido por el profesional actuante.
Dentro de este módulo, que se rendirá en forma trimestral, en expediente separado y hasta 10 pacientes, se adjuntará la planilla de adherencia, debidamente confeccionada por el profesional tratante, correspondiente al trimestre solicitado presentando conjuntamente la petición de la carga viral y cd4 para el mismo período.
Incluye: CV ($ 240,00), CD4 ($ 50,00) y hasta 3 consultas médicas ($ 20 c/u). No se reconocerán otras prácticas o consultas.
|
Valores APE de referencia hasta $ 350 |