Resolución 1432/2025
RESOL-2025-1432-APN-SSS#MS
Ciudad de Buenos Aires, 17/07/2025
VISTO el Expediente N° EX-2025-54654482- -APN-GDYAISS#SSS, la
Resolución N° RESOL-2025-1363-APN-SSS#MS del 14 de julio de 2025, y
CONSIDERANDO:
Que mediante la Resolución mencionada en el Visto se aprobó la creación
del “Programa de Adhesión Voluntaria para la Adquisición de Medicación
de Alto Costo – Emicizumab”, incluyendo en su ARTÍCULO 2° los
“Lineamientos Operativos Generales del Programa”, incorporados como
Anexo I (IF-2025-72356325-APN-GA#SSS).
Que con posterioridad a su dictado, la GERENCIA DE ADMINISTRACIÓN
advirtió un error material involuntario en el citado Anexo I, en tanto
no se corresponde con la versión definitiva oportunamente validada por
las áreas técnicas competentes de esta Superintendencia.
Que de conformidad con lo establecido en el artículo 101 del Reglamento
de la Ley de Procedimientos Administrativo, aprobado por el Decreto Nº
1759/72 (T.0. 2017) los errores materiales o de hecho y los
aritméticos, pueden ser rectificados en cualquier momento, siempre que
la enmienda no altere lo sustancial del acto o decisión, motivo por el
cual corresponde rectificar el Anexo I de la Resolución Nº
RESOL-2025-1363-APN-SSS#MS.
Que la GERENCIA DE ASUNTOS JURÍDICOS toma la intervención de su competencia.
Que la presente se dicta en uso de las facultades y atribuciones
conferidas por los Decretos Nros. 1615 del 23 de diciembre de 1996,
2710 del 28 de diciembre de 2012 y 440 del 27 de junio de 2025.
Por ello,
EL SUPERINTENDENTE DE SERVICIOS DE SALUD
RESUELVE:
ARTÍCULO 1°.– Rectifícase el ARTÍCULO 2º de la Resolución Nº
RESOL-2025-1363-APN-SSS#MS del 14 de julio de 2025, sustituyéndose el
Anexo I (IF-2025-72356325-APN-GA#SSS) por el Anexo I
(IF-2025-76391019-APN-GA#SSS), que forma parte integrante de la
presente medida.
ARTÍCULO 2°.– Comuníquese, publíquese, dese a la DIRECCIÓN NACIONAL DEL
REGISTRO OFICIAL y vincúlese al expediente electrónico que le dio
origen.
Claudio Adrián Stivelman
NOTA: El/los Anexo/s que integra/n este(a) Resolución se publican en la edición web del BORA -www.boletinoficial.gob.ar-
e. 18/07/2025 N° 51058/25 v. 18/07/2025
(Nota
Infoleg:
Los anexos referenciados en la presente norma han sido extraídos de la
edición web de Boletín Oficial)
ANEXO I
PROCEDIMIENTO ADMINISTRATIVO PARA LA
INCORPORACIÓN DE BENEFICIARIOS AL PROGRAMA DE ADHESIÓN VOLUNTARIA PARA
LA ADQUISICIÓN DE MEDICAMENTOS DE ALTO COSTO (EMICIZUMAB)
Objetivo:
Establecer un procedimiento claro y eficiente para la gestión de
autorizaciones, control de consumos y retención de los importes a
cobrar por la provisión de Emicizumab para los beneficiarios portadores
de Hemofilia “A” severa, a ser ejecutado por la Comisión Asesora
técnica de adquisición de medicamentos, insumos y dispositivos, la
Gerencia de Administración, y la Agencia de Recaudación y Control
Aduanero (ARCA).
Alcance: Este
procedimiento aplica a todos los Agentes de Seguro de Salud que
voluntariamente se adhieran al programa de cobertura de Factor
Emicizumab en sus presentaciones de 30 mg/1 ml,60 mg /04 ml,105mg/07 ml
y 150 mg/1 ml con el fin de garantizar la provisión de medicación a sus
beneficiarios.
Una vez que las entidades adhieran al
Programa, aceptan los términos y condiciones que hacen al
funcionamiento normativo y operativo.
I. CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN PARA EL PRGRAMA DE ADHESIÓN VOLUNTARIA PARA LA ADQUISICIÓN DE EMICIZUMAB
Para efectos de este protocolo, las
personas con diagnóstico de Hemofilia A Severa (HAS), que podrán
acceder al programa de adhesión voluntaria para la adquisición de
Emicizumab, deberán cumplir con alguno de los siguientes criterios de
inclusión:
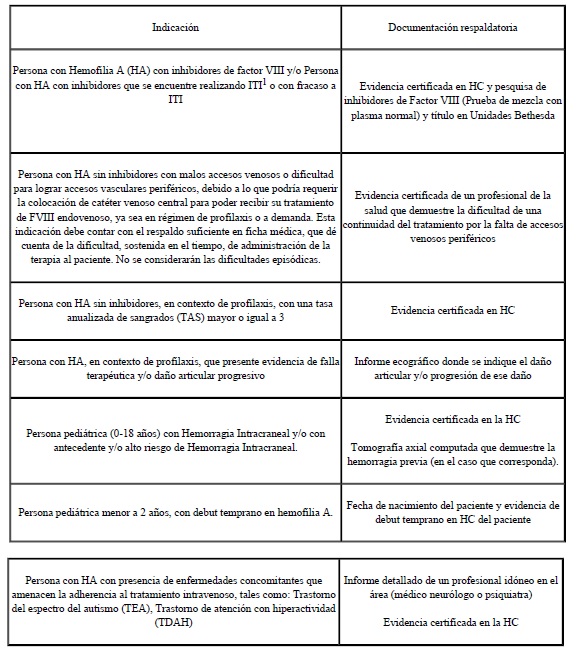
Criterios de Inclusión
1. Persona con HAS con inhibidores de factor VIII
2. Persona con HAS congénita e inhibidores que se encuentre realizando ITI o con fracaso a ITI
3. Persona con HAS sin inhibidores con malos accesos venosos o
dificultad para lograr accesos vasculares periféricos, debido a lo que
podría requerir la colocación de catéter venoso central para poder
recibir su tratamiento de FVIII endovenoso, ya sea en régimen de
profilaxis o a demanda. Esta indicación debe contar con el respaldo
suficiente en ficha médica, que dé cuenta de la dificultad, sostenida
en el tiempo, de administración de la terapia al paciente. No se
considerarán las dificultades episódicas.
4. Persona con HAS sin inhibidores, en contexto de profilaxis, con una tasa anualizada de sangrados (TAS) mayor o igual a 3.
5. Persona con HAS, en contexto de profilaxis, que presenta evidencia
de falla terapéutica a dosis máxima terapéutica y/o daño articular
progresivo.
6. Persona pediátrica (0-18 años) con Hemorragia Intracraneal y/o con antecedente y/o alto riesgo de Hemorragia Intracraneal.
7. Persona pediátrica menor a 2 años, con debut temprano en hemofilia A.
8. Persona con HA con presencia de enfermedades concomitantes que
amenacen la adherencia al tratamiento intravenoso, tales como:
Trastorno del espectro del autismo (TEA), Trastorno de atención con
hiperactividad (TDAH)
Aquellos
pacientes que por lo referido en los criterios de Inclusión tuvieron
que ser tratados con Emicizumab, deberán continuar con el mismo
tratamiento salvo indicación contraria del hematólogo tratante.
Criterios de Exclusión
Los casos referidos a continuación se encuentran excluidos de recibir Emicizumab:
1. Antecedentes de hipersensibilidad al Emicizumab o a otros anticuerpos monoclonales.
2. Antecedentes de hipersensibilidad
al principio activo o a alguno de los excipientes: L-Arginina,
L-Histidina LÁcido aspártico, poloxámero 188.
3. Presencia de alteraciones hematológicas (Hb menor a 8 gr/dL, plaquetas menores a 100.000/mm3).
4. Antecedente de trombosis,
microangiopatía trombótica (MAT) o el uso de fármacos que predispongan
a MAT (ciclosporina, quinina, tacrólimus).
5. Presencia de alteraciones hepáticas
(BT mayor a 1,5 veces el límite superior definido para la edad,
excluido Síndrome de Gilbert, y TGO y/o TGP mayores a 3 veces el límite
superior definido para la edad)
6. Otra enfermedad hemorrágica congénita o adquirida diferente a la Hemofilia A
7. Enfermedad tromboembólica venosa actual o en los 12 meses previos.
II. DOCUMENTACIÓN REQUERIDA PARA EL ALTA DEL BENEFICIARIO AL PROGRAMA (EMPADRONAMIENTO)
Los Agentes del Sistema Nacional del
Seguro de Salud que deseen adherirse al programa deberán incorporar la
siguiente documentación respaldatoria en formato digital
(preferentemente PDF) a la plataforma SIGMAC (Solución Integral de
Gestión de Medicamentos de Alto Costo) desarrollado y administrado por
la Superintendencia de Servicios de Salud y de acuerdo con el
instructivo que oportunamente se pondrá a disposición de los
interesados a través de los canales oficiales de la SSSalud.
a. Declaracion jurada, el titular del Agente del Seguro de Salud cursará una
NOTA DE DECLARACION DE BENEFICIARIO (ANEXO III) dirigida al
Superintendente de Servicios de Salud,
en donde se enuncien los siguientes datos del Beneficiario: Nombre y
Apellido, número de beneficiario, fecha de alta en la Obra Social,
número de documento, C.U.I.L., fecha de nacimiento, sexo, peso
expresado en kilogramos, domicilio, localidad, teléfono de contacto, y
correo electrónico. La nota deberá estar firmada por el presidente del
Agente del Seguro de Salud o apoderado legal del mismo con mandato
específico. La firma del presidente, como en su caso el mandato
específico, deberán estar debidamente certificados por escribano
público. Además, el Agente del Seguro de Salud deberá crear e informar
en la presente declaración jurada una casilla de correo electrónico
exclusiva para recibir notificaciones del programa de hemofilia.
b. Resumen de historia clínica de la
patología, la historia clínica deberá estar firmada por el médico
tratante y auditor de la Obra Social donde conste fecha de inicio de
tratamiento, antecedentes personales y de la enfermedad actual,
complicaciones y/o comorbilidades, y descripción del tratamiento actual
con su detalle e indicando: a) dosis, expresando cantidad de mg/Kg y
frecuencia del tratamiento semanal; b) tipo de presentación utilizado
con indicación de nombre comercial. Firmada por el médico tratante y
constatada por el Auditor de la Obra Social.
c. Prescripción médica original, donde
figure nombre y apellido del paciente, edad, tipo de tratamiento,
(mg/Kg/) y frecuencia semanal avalado con firma y sello del médico
hematólogo o médico tratante en caso de que no hubiera hematólogo con
residencia fija en la localidad.
d. Protocolos de laboratorio, del
nivel de factor VIII inicial que hizo el diagnostico de severidad y
dosaje de inhibidor cuando corresponda. Deberán estar firmados y
sellados por el profesional bioquímico responsable, o bien por el
hematólogo tratante y auditor médico de la obra social.
e. Consentimiento informado, del mismo firmado por el paciente (o su tutor o encargado) y por el médico tratante.
f. Certificado de vacunación para Hepatitis A y B
g. Documentación respaldatoria para presentar según el criterio de Inclusión utilizado en el apartado I del presente Anexo.
III. SOLICITUD DE PROVISIÓN DE EMICIZUMAB
Las solicitudes de provisión deberán cursarse por SIGMAC, requiriendo para ello la siguiente documentación:
a. documentación médica:
• Prescripción médica con firma y sello del profesional tratante.
• Planilla de aplicación que deberá
indicar apellido, nombre, DNI, edad, y peso del beneficiario; además
del período (mes y año) contando con los stickers correspondientes a
los viales consumidos. La misma tendrá que estar firmada por el
beneficiario, tutor o encargado, médico tratante y por el Auditor
Médico de la Obra Social. .
b. Validación y provisión
1. La Comisión Asesora Técnica
evaluará las solicitudes ingresadas a SIGMAC y, en base a la
documentación presentada, podrá autorizarla, rechazarla o requerir
información adicional si es necesario.
2. Si la solicitud es aprobada, SIGMAC
emitirá la Orden de Provisión al proveedor de manera automática con una
notificación al afiliado.
3. El proveedor entregará el
medicamento en un plazo máximo de 72 horas y hasta 10 días hábiles,
conforme al procedimiento licitatorio.
4. En caso de rechazo o revisión, la
Obra Social será notificada por la misma plataforma de SIGMAC y podrá
subsanar las observaciones.
c. Modificaciones en la dosis o tratamiento
Si el tratamiento del beneficiario
requiere cambios en la dosis o cantidad de medicamento por razones
médicas o circunstancias de excepción debidamente justificadas; el
agente del seguro nacional de salud podrá incorporar a través de SIGMAC
• Resumen actualizado de historia clínica.
• Protocolo de laboratorio y, si corresponde, dosaje de inhibidor.
• Justificación médica de adelanto vacacional
IV. LEGAJO DEL BENEFICIARIO Y CONTROL DOCUMENTAL
El Agente del Seguro de Salud deberá conservar en formato digital y
físico la siguiente documentación para auditoría y control de la
SSSalud:
• Historia clínica completa.
• Certificados de vacunación para hepatitis A y B.
• Protocolos de laboratorio
originales: nivel de factor VIII y APTT prolongado, previo al
tratamiento referenciado de Emicizumab; que deberán estar firmados y
sellados por el profesional bioquímico responsable, por el hematólogo
tratante y auditor médico del Agente del Seguro de Salud. En caso de
presencia de inhibidores circulantes, se debe conservar protocolo de
laboratorio con el dosaje del factor inhibidor elevado mayor a 5
Unidades Bethesda al comienzo del tratamiento.
• Prescripción médica vigente.
• Consentimiento informado firmado.
• Registro de aplicaciones mensuales.
• -Certificados de formación en técnicas de autoadministración de factores de coagulación.
La COMISIÓN TÉCNICA DE ADQUISICION DE
MEDICAMENTOS, INSUMOS Y DISPOSITIVOS tiene la amplia facultad de
requerir, en cualquier instancia o momento, la presentación de toda
documentación que no se encuentre expresamente enunciada o prevista en
el presente Anexo, y que considere a su criterio necesaria para la
aprobación de las solicitudes de provisión del medicamento.
V. RETENCIÓN DE IMPORTES POR CONSUMO DE FACTOR VIII
1. La Gerencia de Administración y la
Subgerencia de Presupuesto y Contabilidad recibirán mensualmente los
informes de consumo de la Comisión de Hemofilia.
2. Los importes para retener se calcularán según los valores establecidos en el procedimiento de adquisición de la SSSalud.
3. La SSSalud notificará a ARCA los montos a debitar de las cuentas recaudadoras de las Obras Sociales adheridas al programa.
1. ARCA transferirá las sumas retenidas a la cuenta designada por la
SSSalud.
5. En caso de discrepancias, la
Gerencia de Administración gestionará las comunicaciones con los
Agentes del Seguro de Salud para su resolución.
Disposiciones Finales
La Comisión Asesora Técnica de
Adquisición de Medicamentos, Insumos y Dispositivos podrá solicitar
documentación adicional en cualquier instancia del proceso para validar
la solicitud de provisión.
Este procedimiento garantiza una
gestión digitalizada, ágil y trazable para optimizar la provisión de
Factor VIII a beneficiarios mayores de 22 años, asegurando su acceso
continuo y eficiente.